Вы видите копию треда, сохраненную 3 октября 2018 года.
Можете попробовать обновить страницу, чтобы увидеть актуальную версию.
Скачать тред: только с превью, с превью и прикрепленными файлами.
Второй вариант может долго скачиваться. Файлы будут только в живых или недавно утонувших тредах. Подробнее
Если вам полезен архив М.Двача, пожертвуйте на оплату сервера.
Кто хочет вспомнить химию или ищет книгу - тут вот посоветовали "Общая химия. Глинка Н.Л".
Скачать в PDF можно здесь (44,1 МБ): http://www.200ballov.com.ua/files/chem/glinka.pdf
Вот пару картинок с таблицами Менделеева. Пик4 - цикл Кребса.
Вот ещё пикча побольше, кому для плакатов - она сюда просто не лезет:
http://ogoom.com/uploads/posts/2011-05/ogoom.com_1305370963_mendeleev1.jpg
Также оставлю здесь расширенную таблицу химических элементов, где есть даже Унбигексий:
https://ru.wikipedia.org/wiki/Расширенная_периодическая_таблица_элементов
И ссылку на таблицу нуклидов на английской википедии, там видно типы распадов:
https://en.wikipedia.org/wiki/Table_of_nuclides_(segmented,_narrow)
https://en.wikipedia.org/wiki/Category:Lists_of_isotopes_by_element
Потому что здесь: https://ru.wikipedia.org/wiki/Таблица_нуклидов
По каждому конкретному элементу это поле нужно допиливать.
https://ru.wikipedia.org/wiki/Шаблон:Периодическая_таблица_по_изотопам_элементов
Вот, например можно сравнить внизу таблицы:
https://ru.wikipedia.org/wiki/Изотопы_кислорода
https://en.wikipedia.org/wiki/Isotopes_of_oxygen - тут видно тип распада, каналы распада и вероятность.
Почему карбонильная группа в соединениях, вступающих в реакцию Фриделя-Крафтса, не связывает кислоты Льюиса, выступающие катализаторами, предотвращая реакцию/замедляя её?
Кстати, карбонильная кислота же жёсткое основание? Если мягкое, то ответ вполне очевиден.
Всё полагал, что жёсткое, но вдруг что.
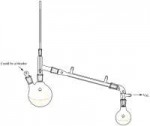
Также имеется переходник (насадка Вюрца штоле?). На второй пикче он. То я туда силиконовую соску накрутил, на боковой отвод, чтобы к нему холодильник (шариковый) можно было присоединить. На переходнике имеется маркировка. Нижний шлиф - 19/26
Короче, надо переходник подобрать. Какие шлифы должны быть у переходника? 19/26 - 29/32? Этот (29/32) в колбу вообще влезет? На третьей пикче он. Или 24/29 нужен?
>Вот и возьми соединения с составом C6-С14Hn, например.
А стоит ли ограничивать температуру плавления? Например взять два множества - с температурой плавления от +15С до +20С и от +20С до +25С? Теоретически это должно также нивелировать разницу между веществами.
>Не очень понял этот пассаж. Можешь пояснить ещё раз для тупых? Структуры тугоплавких веществ слишком сложные для твоей сети?
Грубо говоря - да. Обучение сети нестандартное и зависит от количества простых цепей (смотри теорию графов) в структуре вещества. Т.е. сложные (тугоплавкие) вещества сильно переобучают сеть в свою сторону. Есть вариант, как можно попробовать этого избежать, но пока не пробовал.
Я таки попробую предложенные тобой ограничения сегодня, но всё таки
>есть ли какие-нибудь два свойства вещества, для которых наличие одного исключает наличие другого?
Подобная выборка на самом деле была бы намного предпочтительнее.
В ацилировании по Ф-К хлорид алюминия расходуется как раз на аддукт с кетоном. Но т.к. этот кетон - продукт реакции, скорость не уменьшается, пока есть свободный AlCl3.
Первая цифра - макс. диаметр шлифа, вторая цифра - это длина шлифа. Угол "сужения" у всех шлифов должен быть одинаковый.
А, длина таки. А я-то думал, это два диаметра - больший и меньший. Добра тебе.
Стало быть, если колба у горлышка имеет диаметр 29 - туда смело можно пихать 29/32
>есть ли какие-нибудь два свойства вещества, для которых наличие одного исключает наличие другого?
Свойства, которые тебе кажутся "либо есть, либо нет", по факту являются проекцией более сложного ландшафта на бинарное "есть/нету", с заданным пороговым значением. Реальные вещества об этом не знают, к сожалению, и твоим бинарным классификациям подчиняться не желают. Скажем, опытный нарик, посмотрев на структуру вещества, сразу сможет с некоторой вероятностью предположить, будет ли оно штырить. Но бинарное "штырит"/"не штырит" по сути является отражением действия вещества в сложнейшем механизме, напичканом кучей рецепторов и ферментов, со замысловатой кинетикой, и т.п. Вот эта сложность оценочного механизма в каком-то смысле является расплатой за бинарность классификации. Даже если ты возьмёшь самые понятные для обывателя свойства - скажем, "ядовито/не ядовито", то всё равно твоя бинарная классификация будет в себе нести кучу скрытых предположений: 1) Какой эффект будем считать за "да", а какой - за "нет"? 2) Будем ли учитывать массу тела подопытного животного? 3) Будем ли учитывать вид животного, его генетические особенности, 4)... и так до бесконечности. Невозможно адекватно разбить объект исследования по каким-то абсолютным, заданным свыше категориям. Можно его разбить только по категориям, для которых ты изначально задал строгие рамки определения Курт Гёдель хитро хихикает, но его мы пока оставим за кадром. Даже если ты разбиваешь объекты двух цветов по группам "чёрное" и "белое", то тебе для начала всё равно необходимо ввести определения "чёрного" и "белого". Как-то так. Свойства в каком-то философском смысле не существуют сами по себе, а рождаются определениями Всё есть Пустота. С уважением, ваш Далай Лама.
С температурой плавления (или кипения) я бы для выборки предложил ограничивать не диапазон температур, а структуру веществ в выборке. Скажем, я тебе без всякой нейросети могу построить приблизительный бинарный классификатор для температуры кипения алканов относительно комнатной температуры. Атомов углерода от 1 до 4 включительно для линейной структуры, или до 5 с разветвлённой структурой - соединение будет газом при комнатной температуре. Всё остальное будет либо жидкость, либо твёрдое.
>есть ли какие-нибудь два свойства вещества, для которых наличие одного исключает наличие другого?
Свойства, которые тебе кажутся "либо есть, либо нет", по факту являются проекцией более сложного ландшафта на бинарное "есть/нету", с заданным пороговым значением. Реальные вещества об этом не знают, к сожалению, и твоим бинарным классификациям подчиняться не желают. Скажем, опытный нарик, посмотрев на структуру вещества, сразу сможет с некоторой вероятностью предположить, будет ли оно штырить. Но бинарное "штырит"/"не штырит" по сути является отражением действия вещества в сложнейшем механизме, напичканом кучей рецепторов и ферментов, со замысловатой кинетикой, и т.п. Вот эта сложность оценочного механизма в каком-то смысле является расплатой за бинарность классификации. Даже если ты возьмёшь самые понятные для обывателя свойства - скажем, "ядовито/не ядовито", то всё равно твоя бинарная классификация будет в себе нести кучу скрытых предположений: 1) Какой эффект будем считать за "да", а какой - за "нет"? 2) Будем ли учитывать массу тела подопытного животного? 3) Будем ли учитывать вид животного, его генетические особенности, 4)... и так до бесконечности. Невозможно адекватно разбить объект исследования по каким-то абсолютным, заданным свыше категориям. Можно его разбить только по категориям, для которых ты изначально задал строгие рамки определения Курт Гёдель хитро хихикает, но его мы пока оставим за кадром. Даже если ты разбиваешь объекты двух цветов по группам "чёрное" и "белое", то тебе для начала всё равно необходимо ввести определения "чёрного" и "белого". Как-то так. Свойства в каком-то философском смысле не существуют сами по себе, а рождаются определениями Всё есть Пустота. С уважением, ваш Далай Лама.
С температурой плавления (или кипения) я бы для выборки предложил ограничивать не диапазон температур, а структуру веществ в выборке. Скажем, я тебе без всякой нейросети могу построить приблизительный бинарный классификатор для температуры кипения алканов относительно комнатной температуры. Атомов углерода от 1 до 4 включительно для линейной структуры, или до 5 с разветвлённой структурой - соединение будет газом при комнатной температуре. Всё остальное будет либо жидкость, либо твёрдое.
Ты поехавший? Серьезно, Глинка? "Начала Химии" Кузьменко, вот настоящий труЪ-учебник для продвинутой школьной программы, для универа - половина презентаций лекций лежат на сайтах кафедр высших учебных заведений!
1) 1еще чет
2) 452
3) 45
5) 312
7) 24
8) 25
9) еще чет2
лень делать дальше. а вообще это все гуглится на изи
Вот паскудство. Тогда еще один переходник нужен.
Дохуя таких. Например, бензольное кольцо, имеющее в положениях 1 и 3 по хиральному центру с одинаковыми конфигурациями, скажем, (R,R) 1,3-бис(-CH(OH)CH3)-бензол. В такой молекуле ось симметрии будет проходить через атомы 2,5 в бензольном кольце, но плоскости симметрии не будет.
Спасибо, теперь понял.
С меня как обычно нихуя
>рочно нужны ответы на эти билеты
А мне срочно понадобилось пара тысяч рублей. Представь себе.
И да, с этим в un/
Сначала AlCl3 отрывает хлор от хлорангидрида с образованием катиона ацилия, ацилий вступает в ArSE, и получившийся кетон образует аддукт с AlCl3 (поэтому хлорид алюминия расходуется в ходе ацилирования по Ф-К, в отличие от алкилирования по Ф-К).
>отрывает хлор от хлорангидрида с образованием катиона ацилия
Необязательно катион ацилия должен быть. Банального аддукта с хлорангридридом достаточно, чтобы подвинуть LUMO. Достаточно активная частица, после чего, у тебя продукт сразу аддукт кетона и трихлорида.
Ты так говоришь, будто там только один вариант реализуется.
Нет, не проще, потому что на тетрахлориде есть отрицательный заряд=>это более сильное основание, чем пара на кислороде, а значит эта реакция будет протекать быстрее. К тому же, через протонирование тетрахлорда с последующим выделением хлороводорода протон уходит из реакционной смеси, что также смещает равновесие.
 13 Кб, 913x1235
13 Кб, 913x1235Существуют, но ион-ионные взаимодействия в них никуда не исчезают. Особенно, если нет сольватной оболочки вокруг иона.
Так я про то и говорю, надо смотреть на среду. Ты просто неточно написал утверждение, упирая на заряд.
Пик из книги физическая химия Еремина?
Да, график из Еремина.
Просто протонирование тетрахлорида - это ионный процесс, поэтому я и упирал на наличие заряда. Конечно, стоило дописать, что анион основнее соответствующей сопряженной кислоты.
Если же рассматривать протонирование карбонильного кислорода, то образующийся енон, скорее всего, превратится обратно в кетон. Кроме того, в этом пути все процессы обратимы, а в случае с тетрахлоридом в конце выделяется HCl, который уходит из реакционной смеси.
Апд: Можно проводить реакцию ацилирования с бензолом-d6 и выяснить, образуется ли достаточно устойчивый енон, чтобы успел произойти водородный обмен.
 25 Кб, 728x848
25 Кб, 728x848Переходник с керна 29/32 на муфту 24/29 реально нагуглить? Или (как дiды учили) просто хлебушком замазывать недостающие 5 мм?
 108 Кб, 1280x720
108 Кб, 1280x720Берешь керамическую миску, разъебываешь ее, и осколки используешь в качестве кипелок. Если кипение прекращалось, не забывай досыпать свежих перед следующим нагреванием.
Масло слишком текучее и не инертное. Купи нормальную смазку.
А вообще - колбу нельзя нагревать на прямом пламени горелки. Она ебнет и то, что было в ней - загорится. ПОДУМОЙ
>Берешь керамическую миску
Где ж я керамическую миску возьму-то? Я из того, что дома есть хочу кипелки сделать. Ну там лампочку кокнуть или в аптеке пипеток набрать...
>Масло слишком текучее и не инертное. Купи нормальную смазку.
Так вазелины всякие с канифолью мне конечный продукт ненужными ароматами изгадят. Нагуглил, что можно ФУМ-лентой (тефлоновой, сантехнической) шлифы обматывать. Можно?
>А вообще - колбу нельзя нагревать на прямом пламени горелки. Она ебнет и то, что было в ней - загорится. ПОДУМОЙ
Я же ее грею на соляной бане, на электроплите. Фольгой еще заматываю сверху, чтобы равномерно грелась.
>Где ж я керамическую миску возьму-то? Я из того, что дома есть хочу кипелки сделать. Ну там лампочку кокнуть или в аптеке пипеток набрать...
Фарфоровая, глазурованная посуда. Сверху - слой глазури, но внутри она пористая.
>Так вазелины всякие с канифолью мне конечный продукт ненужными ароматами изгадят. Нагуглил, что можно ФУМ-лентой (тефлоновой, сантехнической) шлифы обматывать. Можно?
Ты продукт не будешь чистить, что ли?
Теоретически можно, практически - я ни разу не использовал ФУМ для шлифовых соединений, хз как оно будет.
>Я же ее грею на соляной бане, на электроплите. Фольгой еще заматываю сверху, чтобы равномерно грелась.
На пике просто спиртовка была.
![Cat-Animal-Pattern-Coffee-Mug-Porcelain-Tea-Milk-Set-With-C[...].jpg](/sci/big/thumb/438819/15270136021580s.jpg) 369 Кб, 800x800
369 Кб, 800x800>Фарфоровая, глазурованная посуда. Сверху - слой глазури, но внутри она пористая.
Посуду бить как-то рука не повернется.
>Ты продукт не будешь чистить, что ли?
Не, я же абсент гнать собрался. Вначале экстракция трав на бульбуляторе Сокслета, потом дистилляция. Там любые посторонние примеси изгадят конечный продукт.
>На пике просто спиртовка была.
"Нагрев колбы" - первая картинка из гугля. Так-то и на экстракторе, прежде чем туда спирт заливать, надо будет попробовать чай заварить. Чтобы понимать, что не так может пойти. Колба там некачественная, или кипелки плохо подобраны, или еще какая ерунда.
Я высушенные измельченные травы для абсента просто в колбу со спиртом засыпал и кипятил с обратным холодильником. Потом и классический процесс с настаиванием на травах использовал. Хуй знает, качество в основном определяется качеством спирта.
Я тоже первый раз, когда делал, настаивал травы в банке. Везде пишут, что две недели настаивать надо. Ну я месяц настаивал, чтобы наверняка. Травы разбухли и впитали в себя половину спирта. Начал отжимать. Мало того, что там потери процентов 30 (нормально отжать не получится без специального пресса), так еще и все вокруг хлорофиллом заляпал, который водой не смывается. Таки можно не отжимать и с травами перегонять, но есть мнение, что травы под конец дистилляции начнут пригорать и загадят напиток запахами горелого.
А Сокслет - вообще бомба. Небольшим количеством растворителя можно из трав все вымыть, оставив одну целлюлозу. Потом травы в экстракторе сменить на свежие и дальше продолжить вымывать. И с отжимкой ебстись не надо, и наверняка все что в травах было в экстракт пойдет.
Главное - чтобы пористая хрень была. Уголь должен сработать, но при этом будет сорбировать экстракт. Мел, по идее, сработает. Но я бы тарелку разбил.
 736 Кб, 1734x1734
736 Кб, 1734x1734>Мел, по идее, сработает
А в реакцию не вступит?
Патрон наверное лучше всего где-нить взять и чем-нить его ебнуть.
Не должен. Можно и патрон разбить, но это все-таки непищевая керамика, хуй знает, что они туда добавляют.
Тефлоновая лента отлично предотвращает залипание шлифов. Вакуум не всегда хорошо держит, тут уж как намотаешь. Много ленты не мотай, одного оборота хватает. С кипелками не изобретай велосипед, а бери обычную керамику, она работает наилучшим образом. Спизди у мамки цветочный горшок, и разбей его. Или обычный красный кирпич где-нибудь найди. Как тебе уже сказали, колбу на прямом пламени не грей. Лучше электроплитка, плюс водяная или масляная баня.
Этот патрон отлично сгодится для кипелок. Ничего он загрязнить не сможет, да и ты же всё равно перегонять собрался.
Бездуховно. Но, сука, максимум эффективно.
Перегонка в любой случае делается.
Что с кипелками делать - так и не придумал.
тест
Правильно, лучше выдумывать проблему на пустом месте.
Другое железо, такое возможно? Вот чветными металлами я покрывал, а железо просто ржавеет и нихуя не наростает, может хим состав нужен особенный?
Нужно электролитическое осаждение. Катод - покрываемая поверхность, стальной анод. В растворе - соль железа II, серная+соляная кислота. Точные составы и методику осаждения не помню, погугли.
Ок, спасибо.
Да, стабилизированная. А без катализатора никак? Где купить/как получить MnO2 я хуй знает, а серебро не слишком эффективно и дорого
Батарейку расковыряй. Там навалом оксида марганца.
 132 Кб, 744x1073
132 Кб, 744x1073Вопрос: какое взрывчатое вещество наиболее подходит под такие условия? Нитроглицерин, гексоген и тротил смотрел, там каждый из компонентов сложный. Везде нужна азотная кислота, которая по дефолту никак не синтезируется в домашних условиях, и её никак нельзя объяснить происхождением от каких-то там местных бактерий.
А хотелось бы реалистично обосновать.
Что если его друг биоинформатик синтезировал для несколько бактерий, совокупная жизнедеятельность которых позволяет организовать цикл получения необходимого вещества?
Не, перебор. Во всех взрывчатках подразумевается сложный техпроцесс, который невозможно реализовать в бактериях. И потом "друг биоинформатик" звучит как "Тони старк, миллиардер, филантроп..."
Ну, он же не целую её сделает, а например, азотную кислоту, про которую ты пишешь. Или на худой конец спиздит её из лаборатории.
Как насчет бактерий с метаболизмом, в котором в качестве источника энергии используются нитроэфиры вместо фосфоэфиров? Ну или азиды получаются на том или ином этапе.
>Во всех взрывчатках подразумевается сложный техпроцесс
Тебе для какой цели взрывчатка то нужна. Почему смотришь тротил всякий?
Просто ферментов нужных нет. Люди синтез многих природных соединений тоже не могут нормально повторить.
Пероксид ацетона.
Ацетон, может, как-то впихивается в бактерий, а вот пероксид водорода — вроде бы метаболит стандартный, жаль только, что он быстро каталазой разлагается прямо в момент своего почвления в живом.
Мимо ни разу не биохимик, мог сказать херню.
Да, ты прав
Почитал вот это https://biomolecula.ru/articles/odisseia-azota
Узнал, что в живой клетке путь от захвата азота из атмосферы до азотной кислоты принципиально возможен (без всяких там платино-родиевых катализаторов). Правда, насколько я понял, азотная кислота будет в малых концентрациях. Таким образом, теоретически, я в своём сюжете могу списать получение азотной кислоты из каких-то бактериальных масс и прочей подобной хуйни.
А имея азотную кислоту и гексаметилентетрамин, персонаж моего рассказа получит гексоген. Или нитроцеллюлозу, если азотную кислоту смешает с целлюлозой.
А я и забыл про него.
>А имея азотную кислоту и гексаметилентетрамин, персонаж моего рассказа получит гексоген. Или нитроцеллюлозу, если азотную кислоту смешает с целлюлозой.
Ему нужна будет конц. азотка. Вообще если у него есть простейший перегонный аппарат. То ему и NO2 от бактерий достаточно будет. Продувая его через воду, он будет получать азотку.
Кстати отличный вариант же. Тупо глина обжаренная. И стоит дешевле, чем тарелки бить.
На двухлитровую колбу надо 5-6 маленьких кипелок, например. У нас в лабе за год поллитровая керамическая миска не полностью истратилась.
Я пацифист. Не могу тарелки бить.
Керамзит сильно шелочит же. Может ебануть.
Капилляры сами по себе ценны, в отличие от сраной разбитой миски.
 90 Кб, 1346x376
90 Кб, 1346x376У капилляров есть один существенный минус где я их возьму?
Что если в качестве кипелок шариков из фольги накрутить? Сработает?
Не бомби няш)))
Он от шапочки из фольги отрывает, не наезжай на него.
 404 Кб, 1536x2048
404 Кб, 1536x2048Посмотри в учебнике Цирельсона по квантовой химии, там все это есть.
Грел колбу на соляной бане. Из обычной кухонной соли. Так она, собака, мне в кастрюле (нержавейка) дно разъедать начала. Заебался, два часа кастрюлю пидорасил химическими и механическими способами, все равно дно выглядит страшно (пикча) (мамка заругает).
Чем можно соль заменить?
Песок, ну или масло. С горячим маслом нужно быть осторожнее, но нагрев будет очень равномерным.
С горячим масло играться ссыкотно. В прошлом году вздумалось мне картошки фри сделать. Весь шкафчик закоптил и немношк потолок.
Где взять песок - не могу придумать.
>все равно дно выглядит страшно (пикча) (мамка заругает).
Мож электролизом ее почистить попробовать. Куда там анод подключать?
а я серьезных не прошу
Он песок достать не может, и битую тарелку. Откуда он силиконовое масло возьмёт? До этих ваших силиконовых масел отлично пользовались вазелиновым, оно хоть и горючее, но при правильном применении достаточно безопасно. Впрочем, для данного пациента лучше песок - целее будет.
>>39905
Хорошая картинка, жизненная. Интересно, что у него там такое случилось, что аж керамическая поверхность плитки треснула?
Точно, совсем забыл про вазелиновое масло.
Плитка могла треснуть от попавшей на нее холодной жидкости, например воды из холодильника. Скорее всего, колба треснула и содержимое колбы/бани вспыхнуло.
Хули там подробно описывать? Ион слабой кислоты/основания в водном растворе менее устойчив, чем соответствующая кислота/основание в недиссоциированной форме. Соответственно, после растворения исходной соли в воде эти ионы превращаются в кислоты/основания, отщепляя H+ или OH- от молекул воды, от этого меняется pH раствора.
>>39964
>Ион слабой кислоты/основания в водном растворе менее устойчив, чем соответствующая кислота/основание в недиссоциированной форме.
Зачем так радикально то. Достаточно быть сравнительно устойчивым с сопряженной кислотой основанием.
>>39965
H+ гипотетическая частица, и нет, ионы не умеют летать, по крайней мере при температурах меньше нескольких тысяч градусов.
Ну ты представь себе голый протон. Он не может свободно существовать. Супераксивный ведь.
>Зачем так радикально то. Достаточно быть сравнительно устойчивым с сопряженной кислотой основанием.
Проще по значению константы кислотности/основности смотреть. У слабых она меньше 1/10000, так что ион действительно неустойчив по сравнению с сопряженной кислотой/основанием.
>H+ гипотетическая частица, и нет, ионы не умеют летать, по крайней мере при температурах меньше нескольких тысяч градусов.
Вообще-то умеют, в масс-спектрометрах. Но согласен, протон - это исключение, у него аномально высокая энергия для своего периода.
>>39968
Все вопросы - к составителям. Согласно NFPA у нее 4/4 и по токсичности, и по пожароопасности.
Ты так просто по константе не поймешь что устойчивее а что нет. Там ведь во всех реакциях вода, и все относительно неё считается.
Смотри сам, кислота, для которой при одинаковой концентрации аниона и кислоты, pH остается как у чистой воды, вполне похожа на ту, у которой устойчивость аниона и кислоты одинаковая. Но при этом константа кислотности у неё, всего 10^-7
 440 Кб, 600x900
440 Кб, 600x900Присоединение метилмагнийбромида с последующим мягким окислением получившегося спирта.
>Смотри сам, кислота, для которой при одинаковой концентрации аниона и кислоты, pH остается как у чистой воды
Куда делись протоны от диссоциировавшей кислоты?
В этом и суть. Что для кислоты с 10^-7 ей и ТАК НОРМ УЖЕ. Если аниона и кислоты одинаковая концентрация.
Но изначально был вопрос о гидролизе соли. В растворе изначально только ионы этой соли, больше ничего туда не добавляют. И почему, по-твоему, в этом случае нельзя использовать соответствующую константу кислотности для оценки стабильности иона?
Потому что во всех реакциях участвует вода, а константа связана с мольной энергией Гиббса всех частиц.
Ну и привожу конкретный пример системы, в которой добавление одинакового количества кислоты и её сопряженного основания, вообще не меняет pH. Казалось бы, они наверное "стоят друг друга", раз ничего не поменялось. А pK -7
Короче, что я имею ввиду, как оценку можно использовать. Но конкретный вывод о том что стабильнее, например при pK=-5, делать нельзя.
Как еще сравнивать стабильность аниона и кислоты в растворе, как не при одинаковой концентрации?
Просто меня передернуло, что раз константа кислотности 0.00001 так значит кислота устойчивее. Это вот не так.
100% помню что там бомбанул масляная ванна. Без подробностей, картинка с чемистри реддита.
Да, я ошибся, признаю. Константа равновесия указывает только на точку, в которой приращение термодинамического потенциала=0, но не на значения тд-потенциала реагентов и продуктов.
>но не на значения тд-потенциала реагентов и продуктов
Тут я не уверен правильно ли понял, но константа равновесия вполне себе указывает на стандартное изменение энергии Гиббса. Проблема скорее в том, что на константу мы смотрим через призму буферной емкости самой воды, и как тут что учитывать не совсем понятно.
А Что с ионами сильной кислоты/основания? Они устойчивы в водном растворе и поэтому pH не меняется? Или процесс там иначе устроен?
Я запутался. Зная константу равновесия, мы можем найти ΔGor (т.е. разницу ΔGof продуктов и реагентов). Если ΔGor<0, значит ли это, что термодинамически продукты устойчивее, чем реагенты (т.к. процесс будет протекать самопроизвольно и в результате энергия системы понизится)?
>если ΔGor<0, значит ли это, что термодинамически продукты устойчивее, чем реагенты
Да, так и есть. Но если бы равновесие было A=B; то никаких подводных камней.
А у нас A+B=C+D; Слева вода справа гидроксоний. И в любой к.о. реакции будет среда. Никуда не деться от неё, и какую часть разницы dG дает среда, а какую кислота с анионом не совсем ясно.
Сильные кислоты/основания полностью диссоциируют на ионы и на этом все.
Слабые диссоциируют обратимо, рассмотрим слабую кислоту:
HA + H2O <-> H3O+ + A- (реакция 1).
Теперь представим, что растворяем в воде соль этой кислоты и сильного основания (MA). Сначала в растворе будут катионы M+ и анионы A-. Получается, что в этом растворе избыток аниона (совсем нет кислоты), и в соответствии с принципом Ле Шателье равновесие должно сместится влево, и какое-то количество аниона превратится в кислоту. Чтобы превратиться в кислоту, анион должен присоединить H+. Как это может произойти:
A- + H3O+ <-> H2O + HA (H3O+ берется из автодиссоциации воды. Их в чистой воде оч. мало, поэтому обычно автопротолиз не учитывают)
A- + H2O <-> OH- + HA (непосредственно то, что называется гидролизом)
В общем, из-за протекания этих реакций и меняется pH раствора. Для соли сильного основания и слабой кислоты он будет >7, для соли слабого основания и сильной кислоты <7, для соли слабого основания и слабой кислоты - надо считать по константам диссоциации.
>>40087
Все, кажется понял. Я имел в виду устойчивость иона/кислоты именно в данной среде, а не самих по себе, но никак этого не обозначил.
http://www.anchem.ru/forum/read.asp?id=7326 - Целлюлозная хроматографическая бумага
Тупые фразы вроде "нахуй тебе бумага, если есть силикагельные пластины" вздребезги разбиваются, когда вы узнаете о людях, которые не могут выбросить первую пластину из партии и отмывают использованные пластины для повторного применения. К слову, сорбфил нихуя не умеет, кроме аналитических силикагельных пластин, потому что там работает безрукое мудачье, которое пыталось когда-то наладить производство препаративных пластин, но ничего не сумело сделать.
Да, я понимаю, что здесь сидят также и продвинутые протиратели штанов, которым чиновник купил ЯМР спектрометр на сверхпроводниках вместе с дачей в Швейцарии, но не всем здесь так повезло.
Суть моего вопроса к анону проста: за что? Существует ли карма? Оценит ли Вишну мои страдания и сделает ли в следующей жизни министром?
 189 Кб, webm,
189 Кб, webm,640x360, 0:02
Но ведь ты тоже пидараха, даже хуже, ты визгливая и тупая раз не можешь купить то что тебе нужно, пришел ныть на анонимный форум.
Я не знаю, с чего ты взял, что я не могу купить. Купить-то я купил, но ты понимаешь разницу между работой в промышленном регионе, где ты любой товар или сырье можешь легко и дешево купить, с работой в дремучем российском лесу, где диковинную заокеанскую штуковину или китайские шелка приходится везти месяц или отдавать ящик водки в обмен тому, для тебя привез? В таких условиях даже тупые бездарные америкосы уделают любого пиздатого гения.
Переезжай сам к диковинами, почему ты еще тут? Может потому что ты там никому не всрался как и здесь?
Молодой был, все было мне легко, не съебался вовремя - нынче тяжелее уже. Вот сижу и кусаю локти лицезрея в ютьюбах купающихся в винах и явствах белых людей.
Помню, как с презрением смотрел на коллегу, который нынче в Оксфорде сидит. Теперь презрение сменилось на зависть.
Подозреваю, что хроматографическую бумагу купить негде лишь потому, что ты остался последний, кому она всё ещё зачем-то нужна.
"Граждане РФ, которые себя плохо вели, после смерти попадают в РФ."
 52 Кб, 600x600
52 Кб, 600x600При нагревании растворимость электронного газа в металле падает и металл теряет проводимость.
А ты тонок. Можно было ещё сказать, что термоэлектронная эмиссия - это когда растворимость электронного газа падает настолько, что электроны начинают улетать.
А ниже критической температуры электронный газ конденсируется в сверхтекучую жидкость, которая не затрачивает энергию при перемещении в атомной решетке, отсюда сверхпроводимость.
Купил кристаллическую щелочь в пластиковой банке со значком PET, а она начала трескаться и как бы проплавляться при хранении и "течь" наружу на уровне каустика.
Ну вообще, в принципе может. там же сложноэфирные связи, кислота и щелочь еще как убивают.
Вот в этой таре у них приобрёл https://www.chipdip.ru/product0/9000048396
Как им письмо без мата составить, но с объяснением, что в такой таре продавать нельзя? В роспотребнадзор напишешь, так эти вовсе запретят к реализации населению.
Фото банки не прилагаю. Так как в перчатках выкинул её в мусорный пакет. Гидроксид пересыпал в стеклянную банку.
PET реагирует с концентрированным раствором щелочи. А с учетом того, что щелочь гигроскопична, в банке будет какое-то количество раствора.
>>40181
Дай им ссылку на какой-нибудь из гайдов по химической устойчивости, там везде написано, что Immediate damage may occur, not recommended for continuous usage.
Стекло тоже реагирует со щелочью. Щелочь и щелочные растворы всегда хранят в пластиковой посуде
Пересыпал в зиплок пакет и положил его в стеклянную банку.
В советский набор юного химика входила та же щелочь в полиэтиленовой таре бутылочке.
Ну так полиэтилен устойчив к действию щелочи, в отличии от полиэтилентерефталата.
>может не те учебники были?
Думаю да.
Мне тоже довольно легко давалась неорга, а орга очень тяжело. При этом в любом случае оргу надо было освоить для олимпиад. Тебе просто нужен мост между оргой и неоргой. Теоретическая химия, для орги и неорги почти одинаковая, поэтому используй её как фундамент в своей голове. И книги тоже более теоретические возьми:
Кляйдн, Курц... и т.п.
>как соединятся
Меня такая постановка всегда пугает.
А какие условия то? Температура? Растворитель? Катализаторы?
Если это алкилирование по Фриделю-Крафтсу, то основным продуктом будет 1-бензил-4-фторбензол на самом деле будет много побочных продуктов
Возьми у мамки все специи, которые у неё есть, и высыпь их в суп. Добавь соль, сахар, уксус, стопку водки, соевый соус, горчицу, хрен и майонез. Вкус будет ровно такой, как ты просишь.
Я вот тут >>39878 Сокслет неправильно заряжал. Из-за ваты образовывается "воздушная пробка" в боковом сифоне. Слив происходит не порциями, а непрерывно по мере поступления конденсата.
Гуглил (на алиэкспрессе), как эту проблему решают в Сокслетах - есть два готовых решения (есть еще и третье решение - набить экстрагируемое сырье в батин носок). Решения на картинках.
На первой картинке - целлюлозные гондоны (бывают из стекловолокна). Стоят они по 125$ за упаковку 25 шт. Лучше уж батин носок использовать.
Специальная стеклянная гильза. Указано, что изготавливается из боросиликатного стекла. А вот из чего изготавливается диск - китайцы умалчивают. Из чего эти диски делают? Пористое стекло как в воронке Шотта? Этот диск одноразовый или спокойно промывается?
Да, это пористое стекло. При бережном обращении служит долго. Однако, хз насколько эффективно экстрактор будет с ним работать, мы обычно экстрагируемую хуйню помещаем либо в покупную гильзу как на первом пике, либо заворачиваем в фильтровальную бумагу (марлю, батин носок, и т.д.)
Если есть фильтровальная бумага, то из неё можно сделать конверт, который затем скрепляется скрепкой. Тоже отлично работает.
Это кривой перевод с китайского. Стекло там.
>Подозреваю, что хроматографическую бумагу купить негде лишь потому, что ты остался последний, кому она всё ещё зачем-то нужна.
Смотри сюда: http://libgen.io/scimag/?s=paper+chromatography&journalid=&v=2015&i=&p=
Да, здесь я, наверное, остался такой последний - остальные съебались давно уже.
Year:1998
Year:1975
Year:1955
Year:1955
Year:1964
Year:1963
Year:1969
Первая страница выдачи по твоей же ссылке.
Ну и причём тут они?
На алиэкспрессе ищи, там дохуя дешёвых и достаточно качественных весов. Какой у тебя бюджет?
С алиэкспресса они мне будут месяц ехать, а я хочу за 2 дня. Бюджет не определён, бриллиантовой окантовки мне не надо, взвешивать отдельные атомы я тоже не собираюсь, нужна обычная карманная хуйня с точностью до сотой грамма, стоящая ровно столько, сколько она стоит. И вообще, вопрос "откуда заказать" — это уже дело десятое, я тут марку качественного не-китаеговна спрашиваю.
А какие уровни есть?
>Первая страница выдачи по твоей же ссылке.
2003
2007
2010
Хуль ты остановился на первых статьях? Да, там говно поиск какой-то.
https://www.sciencedirect.com/science/article/pii/S138917231830063X - Rapid multiplex nucleic acid amplification test developed using paper chromatography chip and azobenzene-modified oligonucleotides - 2018
https://www.sciencedirect.com/science/article/pii/S0039914016307445 - Coupling shell-isolated nanoparticle enhanced Raman spectroscopy with paper chromatography for multi-components on-site analysis - 2017
https://www.sciencedirect.com/science/article/pii/S0021967311012775 - Coupling frontal elution paper chromatography with desorption corona beam ionization mass spectrometry for rapid analysis of chlorphenamine in herbal medicines and dietary supplements - 2011
У бумаги, например, нет конкурентов во вполне конкретной области - водный растворитель при работе с прямой фазой (хроматография или электрофорез). Никакие прямые фазы, вроде оксида алюминия и силикагеля, такого издевательства не выдерживают, как и микроцеллюлоза, а вот натуральная целлюлоза какое-то время назад даже использовалась в качестве связующего для других сорбентов, пока не разработали друагих, хитровыебанных связок.
 453 Кб, 1040x981
453 Кб, 1040x981>It's call sivuha in russia
Лiл, блять, ну возьми тогда в ютуб вбей:
>how to make samogon
Первый линк
Один хуй невкусный самогон получится. От дрожжей, кончено, результат тоже зависит, но не настолько сильно, как от сырья.
Смотря чем этот протон отрывать. Возьмёшь какой-нибудь бензилкалий, и он не только С2, но ещё и тебя самого впридачу отдепротонирует. А "обычной" литий- или магнийорганикой он как правило не отрывается, да.
Хроматографическая бумага чем-то принципиально отличается от качественной фильтровальной бумаги? Алсо, чем тебе обратная фаза не угодила? Ценой?
блэт почти. вбивал в ютуб how to make alcohol/ethanol
А синтетическую ценность такой карбанион имеет? Нигде не нашел упоминания о нем, он же очень неустойчивым должен быть.
>>40519
Растворение - процесс образования раствора. Истинный раствор - однофазная смесь переменного состава, состоящая из 2 и более компонентов, размер частиц которых <1 нм.
>>40525
Хайзенберг, ты заебал.
Чет проиграл с твоего реквеста.
>А мне опять консультация от доброго химика нужна :3
А поясните за водоструйники. Какое они разряжение создают?
Его можно тупо аквариумным компрессором заменить? Другой стороной шланг вставить типа.
бамп. Можно тупо смешать спирт электролит и соль, а потом разделить слои?
Просто никто не выделяет енолят, его сразу вводят в реакцию. И подозреваю, что он тебе нужен для получения фенилацетона.
>>40548
Хуевое разрежение. Миллиметров 15, если сильно повезет. Плюс, в "вакууме" водяной пар, все чувствительное к воде подохнет.
>>40554
Например, более сильная кислота вытесняет более слабую из соли. Угольная кислота слабее соляной, поэтому карбонат кальция растворяется в HCl.
 91 Кб, 960x540
91 Кб, 960x540>Хуевое разрежение. Миллиметров 15, если сильно повезет.
В водоструйнике хуевое разряжение? То есть, аквариумного компрессора будет много и хватит какой-нить самоделки уровня пикрелейтед? Монтажная коробка, компьютерный вентилятор и осталось придумать, как это вентилятор герметично приделать к коробке и как шланг вывести.
>Плюс, в "вакууме" водяной пар, все чувствительное к воде подохнет.
Вот это не понял.
Чтобы ответить на эти вопросы, придется погружаться в физическую химию, а именно в разделы термодинамики и химических равновесий.
Пикрелейтед поделие даст 20 мм.рт.ст.?
>Вот это не понял.
Вода из водоструйника испаряется и водяной пар проникает в систему. Из-за этого чувствительные к воде соединения будут разлагаться (и просушить вещество на водоструйнике тоже не получится).
>>40574
Там много других факторов, помимо реакций обмена.
>А синтетическую ценность такой карбанион имеет?
Не слишком большую. Работать с ним можно, но как правило нахуй не нужно. Собственно, при желании даже метиленхлорид можно отдепротонировать диалкиламидами лития, и это, кстати, более или менее востребованная химия в полном синтезе.
хм, а без погружения никак? полчуается только заучивать какие соли растворяются какие нет? как же бесит заучивать
Ну существуют вообще общие закономерности. Но чтобы разобраться, конечно лучше понимать что такое pH и произведение растворимости.
это я понимаю
 332 Кб, 1000x841
332 Кб, 1000x8411. Есть вообще смысл покупать приблуду пикрелейтед?
2. Чем заменить водоструйный насос? Таки аквариумный компрессор сгодится?
Есть вариант водоструйника из компрессора с замкнутым контуром, который по кругу гоняет воду, это если у тебя проблема с проточной водой. Один минус - эта дичь нагревает воду, так что периодически (раз в 10-20-30 минут, зависит от девайса) её необходимо менять.
Если проблема в деньгах - то водоструйник на развалах можно купить б/у дешёвый, если проблемы с бабосом нет - есть воздушные насосы, но эти стоят дорого.
>>40603
Для начала надо понять, что в химии большинство явлений сначала наблюдаются экспериментально, а потом ищется подходящее теоретическое объяснение. Из-за этого теоретические обоснования часто имеют хуевую предсказательную способность. Пример из теории растворов: есть правила Фаянса, позволяющие предсказать ионный/ковалентный характер связи в бинарных соединениях. Теоретически, соединения с ионным характером связи должны лучше растворяться в воде. Практически - CaF2 по этой теории дохуя ионный, но на практике нихуя не растворяется. Есть теория HSAB (жестких и мягких кислот и оснований Льюиса), которая неплохо работает для солей серебра, например. Но она тоже не объясняет низкую растворимость фторида кальция.
Поэтому забьем хуй на ad-hoc манятеории и рассмотрим растворение с точки зрения беспощадной суки термодинамики. Будем использовать то, что энергия связи всегда положительна, т.е. на разрыв связи нужно затратить энергию.
Процесс растворения можно разделить на несколько элементарных "реакций":
1) Образование места под ион в растворителе. Для этого требуется разрыв связей "растворитель-растворитель" => затрачивается энергия, процесс эндотермический.
2) Выход иона из кристалла. При этом рвутся связи "ион-ион", на это затрачивается энергия, равная энергии кристаллической решетки. Процесс эндотермический.
3) Встраивание иона в растворитель - гидратация. При этом образуются связи "ион-растворитель", процесс экзотермический.
Сложив все это, мы посчитаем тепловой эффект (его также называют энтальпией, ΔH) реакции растворения. Она может быть положительной (эндотермический процесс) и отрицательной (экзотермический процесс). Казалось бы, все просто: больше нуля - само не растворится, меньше - растворится.
Но тут приходит другой термодинамический потенциал и говорит: "Хер тебе в рыло, сраный урод". Это энтропия ΔS - мера "беспорядка" в системе. По стадиям:
1) Происходит упорядочивание частиц растворителя - энтропия незначительно снижается.
2 и 3) Ион выходит из упорядоченного кристалла и попадает в раствор, что поышает неупорядоченность системы => энтропия растет.
Изменение энтропии процесса также можно посчитать из изменения энтропии в элементарных стадиях. Для растворения она всегда положительна.
Итого мы имеем минимум 5 величин, влияющих на самопроизвольность протекания процесса. И, просто поглядев на формулу соединения, все эти величины невозможно оценить. Поэтому их находят экспериментально. Рассчитывать, в принципе, тоже можно, но главный профит экспериментальных данных - в них включены все факторы, которые может не учитывать теор. модель.
Благодаря свойствам термодинамических потенциалов (тут отсылаю к учебнику по физхимии) можно найти изменения ΔH и ΔS для всего процесса сразу, не зная ΔH и ΔS элементарных стадий процесса. В итоге мы приходим к выражению вида: ΔGsol=ΔHsol-TΔSsol. ΔG - изменение свободной энергии Гиббса. Если оно отрицательно - процесс способен протекать самопроизвольно. Если положительно - наоборот.
TL;DR Не существует достаточно хорошей теории, которая позволяла бы предсказывать растворимость солей. Проще всего взять табличные значения термодинамических потенциалов и посчитать изменение энергии Гиббса. А зная ΔG, можно найти концентрации ионов в растворе.
Более-менее развернутое изложение - по ссылкам:
https://www.chemguide.co.uk/physical/energetics/lattice.html
https://www.chemguide.co.uk/physical/energetics/solution.html
http://www.science.uwaterloo.ca/~cchieh/cact/applychem/lattice.html
http://www.science.uwaterloo.ca/~cchieh/cact/applychem/hydration.html
И это я еще не касался кинетического аспекта растворения, протекания параллельных реакций, комплексообразования и т.п.
>>40648
1. Какие ЗАДАЧИ? Что хочешь фильтровать?
2. Компрессор не равно вакуумный насос. Он рассчитан на атмосферное давление на входе, если что.
>>40603
Для начала надо понять, что в химии большинство явлений сначала наблюдаются экспериментально, а потом ищется подходящее теоретическое объяснение. Из-за этого теоретические обоснования часто имеют хуевую предсказательную способность. Пример из теории растворов: есть правила Фаянса, позволяющие предсказать ионный/ковалентный характер связи в бинарных соединениях. Теоретически, соединения с ионным характером связи должны лучше растворяться в воде. Практически - CaF2 по этой теории дохуя ионный, но на практике нихуя не растворяется. Есть теория HSAB (жестких и мягких кислот и оснований Льюиса), которая неплохо работает для солей серебра, например. Но она тоже не объясняет низкую растворимость фторида кальция.
Поэтому забьем хуй на ad-hoc манятеории и рассмотрим растворение с точки зрения беспощадной суки термодинамики. Будем использовать то, что энергия связи всегда положительна, т.е. на разрыв связи нужно затратить энергию.
Процесс растворения можно разделить на несколько элементарных "реакций":
1) Образование места под ион в растворителе. Для этого требуется разрыв связей "растворитель-растворитель" => затрачивается энергия, процесс эндотермический.
2) Выход иона из кристалла. При этом рвутся связи "ион-ион", на это затрачивается энергия, равная энергии кристаллической решетки. Процесс эндотермический.
3) Встраивание иона в растворитель - гидратация. При этом образуются связи "ион-растворитель", процесс экзотермический.
Сложив все это, мы посчитаем тепловой эффект (его также называют энтальпией, ΔH) реакции растворения. Она может быть положительной (эндотермический процесс) и отрицательной (экзотермический процесс). Казалось бы, все просто: больше нуля - само не растворится, меньше - растворится.
Но тут приходит другой термодинамический потенциал и говорит: "Хер тебе в рыло, сраный урод". Это энтропия ΔS - мера "беспорядка" в системе. По стадиям:
1) Происходит упорядочивание частиц растворителя - энтропия незначительно снижается.
2 и 3) Ион выходит из упорядоченного кристалла и попадает в раствор, что поышает неупорядоченность системы => энтропия растет.
Изменение энтропии процесса также можно посчитать из изменения энтропии в элементарных стадиях. Для растворения она всегда положительна.
Итого мы имеем минимум 5 величин, влияющих на самопроизвольность протекания процесса. И, просто поглядев на формулу соединения, все эти величины невозможно оценить. Поэтому их находят экспериментально. Рассчитывать, в принципе, тоже можно, но главный профит экспериментальных данных - в них включены все факторы, которые может не учитывать теор. модель.
Благодаря свойствам термодинамических потенциалов (тут отсылаю к учебнику по физхимии) можно найти изменения ΔH и ΔS для всего процесса сразу, не зная ΔH и ΔS элементарных стадий процесса. В итоге мы приходим к выражению вида: ΔGsol=ΔHsol-TΔSsol. ΔG - изменение свободной энергии Гиббса. Если оно отрицательно - процесс способен протекать самопроизвольно. Если положительно - наоборот.
TL;DR Не существует достаточно хорошей теории, которая позволяла бы предсказывать растворимость солей. Проще всего взять табличные значения термодинамических потенциалов и посчитать изменение энергии Гиббса. А зная ΔG, можно найти концентрации ионов в растворе.
Более-менее развернутое изложение - по ссылкам:
https://www.chemguide.co.uk/physical/energetics/lattice.html
https://www.chemguide.co.uk/physical/energetics/solution.html
http://www.science.uwaterloo.ca/~cchieh/cact/applychem/lattice.html
http://www.science.uwaterloo.ca/~cchieh/cact/applychem/hydration.html
И это я еще не касался кинетического аспекта растворения, протекания параллельных реакций, комплексообразования и т.п.
>>40648
1. Какие ЗАДАЧИ? Что хочешь фильтровать?
2. Компрессор не равно вакуумный насос. Он рассчитан на атмосферное давление на входе, если что.
>Теоретически, соединения с ионным характером связи должны лучше растворяться в воде.
Вут?
Даже теория заряженных шариков и то сложнее делает предсказание, так как учитывает энергию гидратации. Ты немного преувеличил кажется.
А так согласен с аноном, именно это я имел ввиду, под "погружаться в термодинамику". Потенциалы термодинамические только для газов хорошо считаются.
 66 Кб, 612x517
66 Кб, 612x517Имелось в виду "ионные соединения с ионным характером связи". Правила Фаянса гидратацию никак не учитывают, они просто предсказывают характер связи. Просто мне нужно было показать представления, которые исходят только из свойств ионов/атомов, но не из экспериментально определенных величин.
>Отфильтровывать этанол от растительного сырья. Грубо говоря, чай заваривать.
Возьми воронку Бюхнера и бумажные фильтры.
Алсо, ты собрался спирт под вакуумом гнать?
 536 Кб, 1177x528
536 Кб, 1177x528>Возьми воронку Бюхнера и бумажные фильтры.
Это разве не она пикрелейтед?
>Алсо, ты собрался спирт под вакуумом гнать?
Да я собрался спирт под вакуумом гнать. К выходу холодильника можно подключать водоструйник?
Начальный и простой.
Первый том Неорганической химии под ред. Третьякова.
Нормальный и серьезный: "Основы физической химии. Еремин В.В." Плюс лекции по физхе ютубе на канале Nauka0+ на ютубе
Энтри левел: любой учебник неорги для ВУЗов, там есть раздел "хим. термодинамика".
Уровень выпускника химфака: Герасимов, "Курс физической химии". Староват, но при этом - один из последних годных советских учебников, когда авторы еще утруждали себя объяснением того, что они пишут, и при этом не роняли планку в глубине подачи материала.
Еремин, "Основы физической химии: теория и задачи". Ценен в основном задачами, изложение теории так себе.
>>40664
1. Нет, это такая фарфоровая хуйня с дырочками. У тебя на пике фильтр Шотта с приблудой для превращения обычной колбы в колбу Бунзена. Алсо, я бы не брал у китайцев стекло для работы под вакуумом.
2. Во-первых, это плохая идея, больше спирта проебешь при перегонке (Алсо, при работе под вакуумом требования к кипелкам возрастают. Или магнитную мешалку надо юзать). Во-вторых, напора воды после холодильника не хватит. В-третьих, про очки не забудь.
>Во-вторых, напора воды после холодильника не хватит.
Ну блеть, и до холодильника его ставить нельзя - иначе туда пузырики пойдут.
Как водоструйник совместо с холодильником подключить?
>изложение теории так себе
Еремин часто грешит тем. что считает, будто у всех развита мат. интуиция. Ну и если почитать пятый том ЛЛ, то видно, что в изложении он косплеит его.
Как ни странно, на лекциях он более подробно объясняет
либо я более подробных объяснений не видел
 16 Кб, 202x300
16 Кб, 202x300>И вообще, нахуя тебе вакуум?
Абсент делаю. Вон Сокслет специально под это дело прикупил >>39313
Тут на форуме абсентоваров absintheclub.ru практически каждый второй вакуумную дистилляцию делает. Пишут, что так больше эфирных масел в дистиллят летит. Есть там у них даже отдельная тема, как сделать водоструйный насос из говна и палок: http://absintheclub.ru/forum/viewtopic.php?t=1027
А, ну если эфирные масла нужны, то использование вакуума понятно. Но это нарушение технологии, ИМХО. Диды без вакуума гнали и я гоню. Может, проще тогда травы с паром перегнать и экстракт в спирте размешать?
 1,5 Мб, 1679x943
1,5 Мб, 1679x943Смотрел его лекцию и недопонял одной вещи.
"Удвоенная одинарная связь имеет больше энергии чем двойная, т.е. вторая связь менее прочна и она легко разрывается. Именно поэтому этилен активное соединение, а метан - нет"
т.е. активность соединения зависит от прочности связи? или как? и почему именно вторая связь, а первая, к примеру?
а не первая* быстрофикс
>Может, проще тогда травы с паром перегнать и экстракт в спирте размешать?
Не, это хуита будет, а не абсент.
Поясни еще за вакуумную перегонку. Тут вычитал, что для нее колбы обязательно должны быть круглодонными иначе распидорасит. Это правда?
Да, активность в общем случае зависит от прочности связи.
Одинарная связь - это сигма-связь, образованная перекрыванием гибридных орбиталей углерода. Удвоенная одинарная связь ирл не существует, вторая связь в двойной связи - это пи-связь, образованная перекрыванием негибридизованных p-орбиталей углерода. Степень перекрывания орбиталей там меньше, чем в сигма-связи,, поэтому связь слабее.
>>40679
Да, либо круглодонные, либо с "заостренным" дном. Единственная плоскодонная колба, используемая под вакуумом - это колба Бунзена (и да, они регулярно взрываются и по правилам должны быть в металлическом футляре).
>Хроматографическая бумага чем-то принципиально отличается от качественной фильтровальной бумаги?
Хроматографическая бумага - это и есть качественная фильтровальная бумага, без буфера и без пропитки. Основная масса бумаги в параше - это крафт-бумага, которая делается через NaOH+Na2S, что не позволяет до конца гидролизовать все связи с лигниновыми огрызками.
Поскольку там остается лигнин, то бумага никогда не бывает белой - ее обычно отбеливают, что создает кучу карбоксильных групп, в результате чего бумага либо требует буфера, либо быстро деградирует. Со временем этотбеленная бумага желтеет от окисления воздухом. Но даже сразу после отбеливания бумага не получается прозрачной в УФ диапазоне, потому для определения пятен в УФ свете крафт-бумага не подходит.
Ну а по разрешающей способности разница между говеной фильтровальной бумагой и качественной невелика: где-то раза в полтора длиннее пятна на дешевой древесной бумаге, чем на хлопчатобумажной.
>Алсо, чем тебе обратная фаза не угодила? Ценой?
Назови мне российского производителя сорбента обратной фазы? Да, разница по цене на порядок.
Вообще, у меня горит с того, что во всем мире можно по пальцам пересчитать квалифицированных аналитиков, которые умеют сами изготавливать слои и колонки с нуля. В основном мы имеем "операторов", которые знают, какой марки продукцию купить, как ей пользоваться, но как только лишаются доступа к этому производителю, превращаются в слепых беспомощных котят, абсолютно бездарных и бесполезных.
Это примерно как если бы автослесарь лишился фирменных немецких ключей с трещоткой, после чего развел бы руками и сказал "мне нечем работать" - смех да и только.
https://www.chromacademy.com/chromatography-Art-of-HPLC-Method-Development.html - The art of HPLC is dead?
У меня есть воронки Шотта со шлифом, которые вставляются в специальную насадку с отводом под вакуум. В итоге получается примерно то же, что у тебя на рисунке, только разборное.
Водоструй заменяется только дорогостоящими мембранными насосами, для тебя это, скорее всего, значит "ничем".
>Вообще, у меня горит с того, что во всем мире можно по пальцам пересчитать квалифицированных аналитиков, которые умеют сами изготавливать слои и колонки с нуля.
Бугага, это ты верно подметил. Я тебе больше скажу - из тех умельцев, которых мне таки доводилось встречать, ни один не имел отношения к аналитической химии. Аналитика нынче стала областью с пониженными интеллектуальными требованиями. Сделать образцы, засунуть в автосемплер, отослать заказчику результат.
А обратная фаза, причём достаточно качественная, делается относительно легко. Алкилтриэтоксисиланы у правильных поставщиков стоят копейки, особо жадные могут сами их синтезировать хоть литрами. Сушишь силикагель при 150С в вакууме, суспендируешь в толуоле, добавляешь алкилтриэтоксисилан (прикидываешь для начала плотность Si-OH групп на грамм твоего силикагеля), и варишь от пары часов до пары дней, в зависимости от силана. Фильтруешь-моешь-сушишь, получается заебись. Хуй знает, почему готовый C18 силикагель стоит таких безумных денег.
А с фильтровальной бумагой даже не знаю, что тебе сказать. Ради любопытства попробовал просветить УФ хорошую американскую фильтровальную бумагу, так она тоже нихуя толком не просвечивается. Если тебе мешают карбоксильные группы, то наверняка не очень сложно их все проалкилировать.
>Ради любопытства попробовал просветить УФ хорошую американскую фильтровальную бумагу, так она тоже нихуя толком не просвечивается
Как называется марка бумаги?
>Если тебе мешают карбоксильные группы, то наверняка не очень сложно их все проалкилировать.
Понятия не имею, чем это можно сделать, не ухудшив качеств бумаги еще больше. Тут варианта примерно три:
- вымывать буфер и оставлять свободные карбоксильные группы;
- вымывать буфер и заменять аммиаком, если аммиак не будет помехой;
- оставлять буфер, если анализируемое вещество не реагирует ни с карбоксилом, ни с магнием-кальцием.
За рецепт обратной фазы пасибки, стоит действительно относительно дешево, но в розницу нашел только гидрофобизаторы в виде водной эмульсии с неизвестным составом.
Из того, что я читал, я могу предположить, что силанизация все-таки будет неполной, там как-то хитро изворачиваются производители, чтобы повысить качество получаемого силикагеля.
Феноменексом в основном распильные конторы пользуются. В америке есть куча фирм, которые бы ни в какой другой стране не выжили, потому что производимая ими хуйня имеет настолько узкую нишу, что она схлопывается в ноль при отсутствии безпроцентных кредитов в государстве.
Шотт-Дюран, например, неконкурентноспособен, а он жив, тем не менее.
>Как называется марка бумаги?
Whatman general purpose filtration paper. Обещали "These filter papers are made from super-refined cellulose", но что-то в УФ она не шибко прозрачная. Вообще, насколько я помню, ценное отличие крафтс-бумаги заключается в том, что сохраняется максимальная длина волокон. Так что тут, возможно, либо длина волокна, либо без лигнина.
Ну это я так, на пальцах рецепт обрисовал, найди более подробную процедуру в литературе. Ещё забыл упомянуть, что перед сушкой силикагель замачивается в воде градусах при 60, на пару часов - это позволяет прогидратировать поверхность по максимуму, и последующая сушка при 120-150 градусах уберёт только лишнюю воду, но без потери силанолов. Функционализация силанолов довольно легко достигает количественного уровня. Фишка ещё в том, что если у тебя остались какие-то несконденсированные силанолы, то просушка продукта при 200С в вакууме в течении ночи снизит содержание свободных силанолов до гомеопатического уровня. Мы таким образом постоянно делаем 3-(аминопропил)силил-замещённый силикагель, который используем в качестве основы для катализаторов. Ещё я как-то делал перфторалкил-замещённый силикагель, тоже забавная штука получалась. Монослоя перфторалкилов на поверхности вполне хватает, чтобы на ощупь силикагель стал как тефлон.
>>40726
>>40724
Тут ещё стоит учесть гос. и оборонные заказы по особым условиям. Доход с этих заказов обычно позволяет покрывать все прочие издержки бизнеса. Пока в отдельных странах играют в "истинно свободный рыночек, который магически всё порешает по справедливости", в логове капиталистов не особо гнушаются нерыночной подкормкой ценных компаний.
>Whatman general purpose filtration paper. Обещали "These filter papers are made from super-refined cellulose", но что-то в УФ она не шибко прозрачная
Она не отличается существенно от хроматографической, я читал об успешных ее применениях в хроматографии. Хроматографическая бумага у ватмана просто нормируется по скорости течения.
Если поглощение ультрафиолета слабое и равномерное, то это хорошая бумага для ультрафиолета.
>Тут ещё стоит учесть гос. и оборонные заказы по особым условиям. Доход с этих заказов обычно позволяет покрывать все прочие издержки бизнеса. Пока в отдельных странах играют в "истинно свободный рыночек, который магически всё порешает по справедливости", в логове капиталистов не особо гнушаются нерыночной подкормкой ценных компаний.
Это даже не подкормка ценных компаний, а распределение общака между своими. Там полная лояльность режиму - ключевое условие. В рашке тоже подобным занимаются, но в смешных масштабах и с большим нецелевым утоком средств.
>>40729
>тем не менее он есть, а ленхрома нет
Я тебе объясню удивительную особенность рашкинских госзаказов: чем дороже приобретаемые вещи и услуги - тем лучше. На мелких закупках особо не откатишь и не распилишь, потому намного выгоднее закупать оборудование в европе, японии, чем в рашке в 5 раз дешевле.
>На мелких закупках особо не откатишь и не распилишь
Сложно сказать.
Ведь мой ЖЭК судя по документам. закупает два камаза лампочек еженедельно, при этом по 3xрыночной цене.
А на госзакупках я постоянно вижу, что обычные офисные кресла стоят по 1-1.5кк рублей.
Ну если бы твой жэк имел возможность, то закупал бы лампочки в японии еще в 3 раза дороже. Но пока и так норм им, не стоит сильно наглеть.
Если бы у них был возможность, то они бы закрыли производство дешевых лампочек в рашке и возили бы их из японии - вот это был бы шик.
 121 Кб, 890x892
121 Кб, 890x892Есть тут добрый химик, который еще в математику немношк умеет?
Короч, математику в школе прогулял. А в универе проценты не учили, только интегралы и ряды Фурье. Дикий тупняк сейчас ловлю.
Задача.
Есть спирт 96,6% (ректификат).
Есть пластиковый мерный стакан (в пластик нельзя наливать спирт).
Есть довольно точные весы (погрешность 1 грамм).
Есть трехлитровая банка.
Надо в банку отмерить 950 мл 85% спирта.
Я вот тут немношк от балды прикинул. Нигде не ошибся?
9500.85=807.5 - необходимое количество "абсолютного спирта" (сферического, стопроцентного).
807.5/0.966=836 - необходимое количество 96.6% спирта. (плюс 164 мл воды = 950 мл).
Плотность спирта - 0,7893 г/см^3;
8360.7893 = 660 грамм спирта надо отвесить (3.4% примесей в спирте спишем на погрешность весов).
То есть, банку на весы поставил. TARE сбросил и льешь пока весы 660 грамм не покажут. Сверху 164 мл воды мерным стаканом.
Знаки умножений разметкой схавались. Фикс:
>950 х 0.85 = 807.5 - необходимое количество "абсолютного спирта" (сферического, стопроцентного).
>807.5 / 0.966 = 836 - необходимое количество 96.6% спирта. (плюс 164 мл воды = 950 мл).
>Плотность спирта - 0,7893 г/см^3;
>836 х 0.7893 = 660 грамм спирта надо отвесить (3.4% примесей в спирте спишем на погрешность весов).
>Вообще, у меня горит с того, что во всем мире можно по пальцам пересчитать квалифицированных аналитиков, которые умеют сами изготавливать слои и колонки с нуля. В основном мы имеем "операторов", которые знают, какой марки продукцию купить, как ей пользоваться, но как только лишаются доступа к этому производителю, превращаются в слепых беспомощных котят, абсолютно бездарных и бесполезных.
ЧТО БЫЛО В 20 ВЕКЕ. ЧТО МЫ ПОТЕРЯЛИ.
1. Теплоизоляцию делали из асбеста. можно было людей травить.
2. Индукция магнитного поля в ЯМР-спектрометре была слабее процентов на 80. люди неделю спектр снимали.
3. Химик жил в среднем 150-190 лет. болезней не существовало кроме химических ожогов.
4. Если в коридоре споткнешься и прибор стеклянный уронишь - стеклодувы подбегали, деньги в карман засовывали, в губы целовали, предлагали новый сделать.
5. Примеси от продукта сами отделялись
Растворители берешь на складе ЛВЖ - тебе еще аргон выдают.
6. Дед рассказывал: люди ночью просыпались от внезапного озарения. Утром все обливались жидким азотом из дьюара.
7. Срок написания докторской составлял 4.5 месяца. Диссертации были на 1000 страниц, результаты сразу на производстве внедрялись.
8. Вода в Волге была сладкая как аспартам. А Енисей состоял из брома.
9. Зимою было минус триста, на все лето азот намораживали.
10. Калькуляторы были с книжку размером. Книжки были с компьютер, компьютер с лабораторию, а лаборатория как институт, а в инcтитуте кхны спектры рисовали по методике Эрнста - интерферограмму преобразовывали с первого хода!
 137 Кб, 1905x976
137 Кб, 1905x976Из википедии взял. Я так думаю, что 100%, 20°С.
У 96.6% спирта плотность выше и там таки не 660 грамм надо брать, а около 673.
Также там в моих расчетах
>(плюс 164 мл воды = 950 мл).
Опечатка. 114 имелось ввиду.
Но тут мне в жж-шочке подсказали, что водно-спиртовой раствор КУКОЖИТСЯ. Смешав 50 мл воды с 50 мл воды, получим на 100 мл раствора, а 96.4 (http://chem21.info/info/66551/). Поэтому воды придется взять больше: вместо 114 мл придется взять 130 мл.
Короч, онлайн калькулятор полчаса назад нагуглил и он вроде бы точно считает. В граммах там, в процентах.
Тебе какая доля спирта нужна, массовая или объемная? Если объемная, то никакую массу/плотность считать не нужно.
>массу считать не нужно.
Мне надо получить 950 мл, в котором будет 85% объемных долей спирта. Причем спирт (96.6%) надо отвесить в граммах и долить к нему воды в миллилитрах до необходимой концентрации.
Там же выше написал, что есть только пластиковый мерный стакан, в который нельзя лить спирт, чтобы его вонючими пластиковыми привкусами не забобрить. Воду в этот стакан лить можно.
И есть точные весы, которыми можно спирт отмерять в граммах.
> в котором будет 85% объемных долей спирта
Тогда пересчитывай по новой. Тут не так в лобешник всё считается.
 255 Кб, 479x479
255 Кб, 479x479Ты там героин что-ли развешиваешь, чтобы такие вопросы задавать?
>>40785
>>40787
У тебя порочный подход к приготовлению растворов. При приготовлении раствора с заданной объемной долей никогда не рассчитывают объем растворителя. Берут нужный объем в-ва и разбавляют растворителем до итогового объема. Поэтому тебе и нужна будет мерная посуда для приготовления раствора. Я рекомендую купить 2 мерных цилиндра - маленький для спирта и большой для разведения спирта водой.
Алсо, если стакан полиэтиленовый - в него можно наливать спирт. Один хуй из ректификата хороший абсент ты не сделаешь.
Все весы калибруются гирями с определенной массой, соответственно, показывают они именно массу взвешиваемого, а точнее отношение массы взвешиваемого к массе калибровочной гири.
я однажды видел 5-литровый мерный цилиндр
Совершенно избыточна для бытового применения.
В локалке некоторых институтов целые коллекции литературы были, которые разносились по рукам.
 148 Кб, 1074x318
148 Кб, 1074x318Только на вики, три способа синтеза амфетамина.
Анон, я посмотрел методы обращения силикагеля, описываемая тобой классическая процедура описывается, например, здесь:
Chemically bonded stationary phases for aqueous high-performance exclusion chromatography - https://dx.doi.org/10.1016/s0021-9673(01)92047-3
и что-то меня опечалила ситуация. Дело в том, что минимальные кол-ва воды или спиртов сильно ухудшают результат, потому силикагель высушивается в вакууме после гидроксилирования, силанизация ведется в безводной среде, а температура берется такая, чтобы спирт отгонялся сразу по мере его образования, и желательно вообще кочегарить выше 200 С в каком-нить додекане на рефлюксе (287 °C), потому что алкоксилированные силаны намного менее реактивны, чем хлорсиланы. Еще можно толуолсульфоновую добавлять для повышения реактивности. Но даже это не спасает от образования свободных силанов, которые в качественном продажном гидрофобном сорбенте отсутствуют, потому что производитель после первичной силанизации вторично силанизирует коротышками вроде гексаметилдисилазана, триметилхлорсилана, или триметилсилилимидазола.
Вы проверяли свои обращенные фазы чем-нибудь вроде метилового красного? Если не было дополнительной обработки свободный силанов, то метиловый красный точно покажет положительную реакцию, другое дело, что она может быть слабой, а может быть такой сильной, что сорбент мало чем будет отличаться от простого силикагеля с адсорбированным вазелином\мин маслом\резиной\силиконом.
Вот здесь, например
Studies on the reversed-phase thin-layer chromatography of ecdysteroids on C12 bonded and paraffin-coated silica - https://doi.org/10.1016/S0021-9673(00)87267-2
сравнивают силикагель, пропитанный минеральным маслом, с продажными пластинками того времени RP-12 от ватмана, и разрешение на пропитанных пластинках получается незначительно лучше, чем на химически обращенной фазе.
Еще одно исследование от них же:
Factors affecting the ion-pair reversed-phase thin-layer chromatography of organic acids on paraffin-coated and C18 bonded silica gel - https://doi.org/10.1016/S0021-9673(01)92770-0
Здесь исследуются такие "сильнополярные" вещества, как аминосалициловая и дигидроксибензойные кислоты, и результаты получаются примерно одинаковые на пропитанной и химически измененной фазе.
Преимуществ у химического обращения тогда остается немного: безводные растворители не повреждают сорбент, можно смывать анализируемое вещество без примеси пропитки. Вазелин флуоресцирует в УФ, так что здесь на отсутствие флуоресценции не пожалуешься.
Вы спросите: почему же тады мерк и махарей-нагель продают пластинки силанизированного силикагеля? А потому что пропитанные пластинки продавать нет смысла - пропитывать прямую фазу ты будешь уже сам.
Анон, я посмотрел методы обращения силикагеля, описываемая тобой классическая процедура описывается, например, здесь:
Chemically bonded stationary phases for aqueous high-performance exclusion chromatography - https://dx.doi.org/10.1016/s0021-9673(01)92047-3
и что-то меня опечалила ситуация. Дело в том, что минимальные кол-ва воды или спиртов сильно ухудшают результат, потому силикагель высушивается в вакууме после гидроксилирования, силанизация ведется в безводной среде, а температура берется такая, чтобы спирт отгонялся сразу по мере его образования, и желательно вообще кочегарить выше 200 С в каком-нить додекане на рефлюксе (287 °C), потому что алкоксилированные силаны намного менее реактивны, чем хлорсиланы. Еще можно толуолсульфоновую добавлять для повышения реактивности. Но даже это не спасает от образования свободных силанов, которые в качественном продажном гидрофобном сорбенте отсутствуют, потому что производитель после первичной силанизации вторично силанизирует коротышками вроде гексаметилдисилазана, триметилхлорсилана, или триметилсилилимидазола.
Вы проверяли свои обращенные фазы чем-нибудь вроде метилового красного? Если не было дополнительной обработки свободный силанов, то метиловый красный точно покажет положительную реакцию, другое дело, что она может быть слабой, а может быть такой сильной, что сорбент мало чем будет отличаться от простого силикагеля с адсорбированным вазелином\мин маслом\резиной\силиконом.
Вот здесь, например
Studies on the reversed-phase thin-layer chromatography of ecdysteroids on C12 bonded and paraffin-coated silica - https://doi.org/10.1016/S0021-9673(00)87267-2
сравнивают силикагель, пропитанный минеральным маслом, с продажными пластинками того времени RP-12 от ватмана, и разрешение на пропитанных пластинках получается незначительно лучше, чем на химически обращенной фазе.
Еще одно исследование от них же:
Factors affecting the ion-pair reversed-phase thin-layer chromatography of organic acids on paraffin-coated and C18 bonded silica gel - https://doi.org/10.1016/S0021-9673(01)92770-0
Здесь исследуются такие "сильнополярные" вещества, как аминосалициловая и дигидроксибензойные кислоты, и результаты получаются примерно одинаковые на пропитанной и химически измененной фазе.
Преимуществ у химического обращения тогда остается немного: безводные растворители не повреждают сорбент, можно смывать анализируемое вещество без примеси пропитки. Вазелин флуоресцирует в УФ, так что здесь на отсутствие флуоресценции не пожалуешься.
Вы спросите: почему же тады мерк и махарей-нагель продают пластинки силанизированного силикагеля? А потому что пропитанные пластинки продавать нет смысла - пропитывать прямую фазу ты будешь уже сам.
О, ты умный. А ну расскажи такую штуку:
Если нитрат аммония смешать с перманганатом калия (в жидкости) - будет реакция?
Даже не знаю, из-за чего ты там сумел опечалиться. Статья по первой ссылке отлично иллюстрирует все ключевые моменты. Во-первых, силикагель действительно нужно вначале замачивать в воде, а потом сушить. Суть в том, чтобы максимально прогидратировать поверхность, а затем убрать воду с поверхности, не растеряв силанолов. Сушат обычно при 120-150С, выше 200 начинается конденсация силанолов с потерей воды. Кстати, регулируя температуру сушки выше 250С, можно отлично регулировать среднюю плотность силанолов на квадратный нанометр, но тебе это не нужно. Вакуум не обязателен - мы им пользуемся, но и без него всё отлично работает, просто время сушки чуть дольше. Советы про кипящий додекан я встречал, но это какие-то ебучие религиозные ритуалы, необходимости в этом нет. Первая картинка по первой ссылке в твоём посте отлично показывает, что даже в бензоле реакция заканчивается всего за 12 часов. Мы обычно используем кипящий толуол, этанол оттуда улетает со свистом. Кипятим максимум сутки. Толуолсульфоновую кислоту нинада - это видать придумали те же паникёры, которые варят силикагель в кипящем додекане. Реакция действительно простая, как тапок. Не сложнее, чем одна стадия какого-нибудь простенького оргсинтеза. Силилирование свободных силанолов - достаточно обычная процедура в химии силикагеля, но оно редко бывает критически необходимо. Просто в конце реакции добавляешь гексаметилдисилазан, и варишь ещё какое-то время. Это тоже копеечный ингредиент. Свободные силанолы отлично детектятся в ИК-спектре. Мы на наш силикагель обычно вешаем достаточно чувствительную металорганику, и свободные силанолы нам тоже ни к чему, но мы их не замечаем. ХЗ, может в хроматографии действительно они прямо таки критичны в чём я очень сомневаюсь - пропитанные вазелином пластинки работают не сильно хуже обратной фазы, а силанолов там полный комплект, но тогда вопрос решается добавлением гексаметилдисилазана. Мы ещё иногда такой фокус проворачиваем: моем продукт водой, чтобы гидролизовать случайно затесавшиеся этоксисилильные группы, а потом сушим при высокой температуре в вакууме, чтобы сконденсировать высвободившиеся силанолы. Но я что-то сомневаюсь, что от этой процедуры есть какой-то толк. В любом случае, продукт сразу из реакционной смеси промывается толуолом и ДХМ, а нужна ли вода, мы так и не определились. Вот что имеет значение, так это марка используемого силикагеля, можно получить очень разные продукты.
Преимущество обратной фазы именно в том, что алкилы сидят на силикагеле, и не отваливаются. Помыл колонку ацетонитрилом или метанолом, и снова в путь. А с пропиткой наверняка колонна быстро засирается.
Даже не знаю, из-за чего ты там сумел опечалиться. Статья по первой ссылке отлично иллюстрирует все ключевые моменты. Во-первых, силикагель действительно нужно вначале замачивать в воде, а потом сушить. Суть в том, чтобы максимально прогидратировать поверхность, а затем убрать воду с поверхности, не растеряв силанолов. Сушат обычно при 120-150С, выше 200 начинается конденсация силанолов с потерей воды. Кстати, регулируя температуру сушки выше 250С, можно отлично регулировать среднюю плотность силанолов на квадратный нанометр, но тебе это не нужно. Вакуум не обязателен - мы им пользуемся, но и без него всё отлично работает, просто время сушки чуть дольше. Советы про кипящий додекан я встречал, но это какие-то ебучие религиозные ритуалы, необходимости в этом нет. Первая картинка по первой ссылке в твоём посте отлично показывает, что даже в бензоле реакция заканчивается всего за 12 часов. Мы обычно используем кипящий толуол, этанол оттуда улетает со свистом. Кипятим максимум сутки. Толуолсульфоновую кислоту нинада - это видать придумали те же паникёры, которые варят силикагель в кипящем додекане. Реакция действительно простая, как тапок. Не сложнее, чем одна стадия какого-нибудь простенького оргсинтеза. Силилирование свободных силанолов - достаточно обычная процедура в химии силикагеля, но оно редко бывает критически необходимо. Просто в конце реакции добавляешь гексаметилдисилазан, и варишь ещё какое-то время. Это тоже копеечный ингредиент. Свободные силанолы отлично детектятся в ИК-спектре. Мы на наш силикагель обычно вешаем достаточно чувствительную металорганику, и свободные силанолы нам тоже ни к чему, но мы их не замечаем. ХЗ, может в хроматографии действительно они прямо таки критичны в чём я очень сомневаюсь - пропитанные вазелином пластинки работают не сильно хуже обратной фазы, а силанолов там полный комплект, но тогда вопрос решается добавлением гексаметилдисилазана. Мы ещё иногда такой фокус проворачиваем: моем продукт водой, чтобы гидролизовать случайно затесавшиеся этоксисилильные группы, а потом сушим при высокой температуре в вакууме, чтобы сконденсировать высвободившиеся силанолы. Но я что-то сомневаюсь, что от этой процедуры есть какой-то толк. В любом случае, продукт сразу из реакционной смеси промывается толуолом и ДХМ, а нужна ли вода, мы так и не определились. Вот что имеет значение, так это марка используемого силикагеля, можно получить очень разные продукты.
Преимущество обратной фазы именно в том, что алкилы сидят на силикагеле, и не отваливаются. Помыл колонку ацетонитрилом или метанолом, и снова в путь. А с пропиткой наверняка колонна быстро засирается.
Что из этого продается в больших количествах по 1-10кг? Как выглядит реакция селитры с пропаном?
Да, высокая температура скорее использовалась для того, чтобы снизить площадь поверхности силикагеля, что приводит к повышению кол-ва отложений силана (удивительно, но факт):
Empirical correlation of layer thickness and support pore size in “chemically bonded” phases - https://dx.doi.org/10.1016/s0021-9673(00)81540-x
Для хроматографии это не актуально, я бы сказал, 120 С - это самый раз.
Про сравнение с пропитанным силикагелем я писал потому, что такая пропитка является реально хорошей альтернативой химическому изменению и делается намного проще и быстрее. Для повторно используемой колонки хим связь была бы предпочтительна, именно такие адсорбенты используются в ВЭЖХ, но для тонкого слоя прекрасно бы подошла микрокристаллическая целлюлоза, пропитанная вазелином.
Вы там только силикагелем балуетесь? Я просто последние пару месяцев ломал голову над тем, почему минимальные отклонения содержания метанола в растворителе так адово меняют картину на бумаге и силикагеле, и обнаружил, что эта тема не затронута в абсолютном большинстве книг по хроматографии, то есть, книги в этой сфере пишутся ни о чем по сути.
Метанол в данном случае становится статичной фазой, может ложиться градиентом, что оказывает оказывает огромное влияние на движения слабополярных веществ, например, ароматических гидразонов и азобензолов.
Это случайно не ты мне когда-то писал про то, что результаты хроматографии на тонком слое силикагеля и на колонке разнятся? Я просто столкнулся с этим и разобрался с причиной: биндер в продажных пластинах сильно изменял значение задержки, тогда как гипс с силикагелем давал результат, очень похожий на силикагельную колонку.
Еще тот оратор писал про намерение делать хроматографию аминов на оксиде алюминия - это очередной вопрос, который практически никак не освещен в литературе. Амин должен либо содержать полярные группы, либо быть умеренно протонированным - вот рецепт успеха, который я на тот момент еще не знал.
>что приводит к повышению кол-ва отложений силана
Увеличивать количество силана таким топорным способом - затея не из лучших. У них, видимо, силикагель терял воду, которая гидролизовала силан, и полученные олигомеры уже цеплялись на поверхность. В принципе, тебе никто не мешает взять столовую ложку силикагеля на ведро силана, и добавить ещё ведро воды для гидролиза. Получится чача, которая будет на 90% состоять из алкильных хвостов, но это скорее всего будет говно, а не сорбент.
Ты меня, конечно, удивил - я не ожидал, что пропитка вазелином так хорошо работает. Ну т.е. я сам пропитывал силикагель разными веществами для всяких сложных случаев - скажем, нитратом серебра, чтобы делить неполярные алкены. Но вот то, что с вазелином получается не какая-то жирная хуйня, а реально употребимый сорбент, я бы предположить не смог.
Мы вообще занимаемся разными носителями для катализаторов. Разные виды окиси кремния, цеолиты, окись титана всех видов, окись алюминия, церия, и всего прочего. Я просто в прошлом - органик, и слово "силикагель" для меня значит куда больше, чем для тех, кто всю жизнь занимается катализом.
С метанолом прикол очень известный в среде органиков. ХЗ, ты видимо не там искал - хроматографистам это может и неведомо, но любой органик скрючит рожу от перспективы делить что-нибудь на колонке в системе с метанолом. Всего пара процентов метанола в смеси, и колонка одного и того же размера сможет поделить уже не 200, а 50 мг вещества. И фронт вещества из ровной линии превращается в какую-то рваную кашу. В целом, эффект достаточно простой - метанол забивает все те поверхности, которые бы иначе взаимодействовали с твоим веществом. У силикагеля большое сродство к воде, а метанол тут недалеко ушёл. Кстати, метанол ещё отлично вымывает силикагель из колонки. Если метанола в системе много, на выходе получишь продукт вперемешку с силикагелем, даже если внизу колонны хороший слой песка.
Не, это был другой анон. Я как-то никогда не задумывался, почему Rf на силикагеле и колонне получаются разные. Просто имел свой набор лайфхаков для того, чтобы пересчитывать системы растворителей из "ТСХ" в "колонка".
Оксид алюминия - это забытое искусство предков. В целом, его три основных категории: кислый, нейтральный, и основной. И для аминов лучше всего работает основной - на кислый амин может сесть наглухо. Окись алюминия действительно хорошо работает для полярного говна, которое противно тянется на силикагеле. Только вот растворители как правило нужны другие, ну и ёмкость сорбента гораздо ниже, для серьёзной хроматографии нужно дохуя окиси алюминия. Кстати, на обычном силикагеле при правильном подходе можно хроматографировать адски полярное говно. Я как-то делил поликатионные алкилпиридиниевые соли в системе вода-нитрометан-гексафторфосфат аммония. Хуй знает, кто до этого додумался, но я бы в жизни не предположил, что хуйня с 4 положительно заряженными пиридиниевыми центрами будет в этой системе бодро ползти вверх на обычной силикагельной пластине.
>что приводит к повышению кол-ва отложений силана
Увеличивать количество силана таким топорным способом - затея не из лучших. У них, видимо, силикагель терял воду, которая гидролизовала силан, и полученные олигомеры уже цеплялись на поверхность. В принципе, тебе никто не мешает взять столовую ложку силикагеля на ведро силана, и добавить ещё ведро воды для гидролиза. Получится чача, которая будет на 90% состоять из алкильных хвостов, но это скорее всего будет говно, а не сорбент.
Ты меня, конечно, удивил - я не ожидал, что пропитка вазелином так хорошо работает. Ну т.е. я сам пропитывал силикагель разными веществами для всяких сложных случаев - скажем, нитратом серебра, чтобы делить неполярные алкены. Но вот то, что с вазелином получается не какая-то жирная хуйня, а реально употребимый сорбент, я бы предположить не смог.
Мы вообще занимаемся разными носителями для катализаторов. Разные виды окиси кремния, цеолиты, окись титана всех видов, окись алюминия, церия, и всего прочего. Я просто в прошлом - органик, и слово "силикагель" для меня значит куда больше, чем для тех, кто всю жизнь занимается катализом.
С метанолом прикол очень известный в среде органиков. ХЗ, ты видимо не там искал - хроматографистам это может и неведомо, но любой органик скрючит рожу от перспективы делить что-нибудь на колонке в системе с метанолом. Всего пара процентов метанола в смеси, и колонка одного и того же размера сможет поделить уже не 200, а 50 мг вещества. И фронт вещества из ровной линии превращается в какую-то рваную кашу. В целом, эффект достаточно простой - метанол забивает все те поверхности, которые бы иначе взаимодействовали с твоим веществом. У силикагеля большое сродство к воде, а метанол тут недалеко ушёл. Кстати, метанол ещё отлично вымывает силикагель из колонки. Если метанола в системе много, на выходе получишь продукт вперемешку с силикагелем, даже если внизу колонны хороший слой песка.
Не, это был другой анон. Я как-то никогда не задумывался, почему Rf на силикагеле и колонне получаются разные. Просто имел свой набор лайфхаков для того, чтобы пересчитывать системы растворителей из "ТСХ" в "колонка".
Оксид алюминия - это забытое искусство предков. В целом, его три основных категории: кислый, нейтральный, и основной. И для аминов лучше всего работает основной - на кислый амин может сесть наглухо. Окись алюминия действительно хорошо работает для полярного говна, которое противно тянется на силикагеле. Только вот растворители как правило нужны другие, ну и ёмкость сорбента гораздо ниже, для серьёзной хроматографии нужно дохуя окиси алюминия. Кстати, на обычном силикагеле при правильном подходе можно хроматографировать адски полярное говно. Я как-то делил поликатионные алкилпиридиниевые соли в системе вода-нитрометан-гексафторфосфат аммония. Хуй знает, кто до этого додумался, но я бы в жизни не предположил, что хуйня с 4 положительно заряженными пиридиниевыми центрами будет в этой системе бодро ползти вверх на обычной силикагельной пластине.
Это и есть "реакция"? Выкристаллизовать другую соль? Я думал что-то уникальное будет.
Типа как аммиак с перосматами
>Ты меня, конечно, удивил - я не ожидал, что пропитка вазелином так хорошо работает
Я вообще сам себя удивил. В последнее время регулярно удивляюсь, потому что вне книжек, оказывается, есть целый мир. К сожалению, ты тоже в сфере хроматографии демонстрируешь книжные знания, что меня печалит, потому что наверняка есть много малоизвестных знаний, которые мне придется продолжать самостоятельно копать.
>Разные виды окиси кремния, цеолиты, окись титана всех видов, окись алюминия, церия, и всего прочего.
Я недавно синтезировал молекулярные сита, которые Linde Type A, и был удивлен тому, что это, оказывается, мелкий порошок из кубиков микрометровых размеров, которые еле видны в оптический микроскоп. А также неприятно удивлен тому факту, что сита 3Å фактически никто не продает, хотя в название "3Å" лепят. В лучшем случае это 4Å, в худшем - просто глина. Приходится заказывать у импортеров авторитетных марок.
>любой органик скрючит рожу от перспективы делить что-нибудь на колонке в системе с метанолом
Эффектами изменения сорбента метанолом можно и нужно пользоваться. Где-то очень давно встречал сравнение зависимости разделяемости веществ от состава подвижной фазы, где показывалось, что метанол-хлороформ делит лучше, чем чистый хлороформ или хлороформ с этилацетатом. Там были красивые графики, которые показывают зависимость Rf двух веществ от состава растворителя, и видно, что смешанные разнородные растворители делят лучше, чем каждый из них по отдельности или однородные любого состава. Я тогда сразу не понял ценность информации, потому не схоронил.
>метанол ещё отлично вымывает силикагель из колонки. Если метанола в системе много, на выходе получишь продукт вперемешку с силикагелем, даже если внизу колонны хороший слой песка.
http://www.flash-purification.com/does-methanol-really-dissolve-silica-during-flash-column-chromatography/ - Does methanol really dissolve silica during flash column chromatography?
https://chemtips.wordpress.com/2013/02/01/is-silica-soluble-in-methanol/ - Is Silica Soluble in Methanol?
Действительно вымывает, но только из острогранного силикагеля и только мельчайшие обломки. Даже вода сама по себе не вымывает, она просто химически изменяет силикагель и он рассыпается.
>Оксид алюминия - это забытое искусство предков. В целом, его три основных категории: кислый, нейтральный, и основной
Вот, это книжное знание. На самом деле бывает единственный оксид алюминия - нейтральный, остальные - это его модификации.
У меня складывается ощущение, что эта сфера под давление коммерсантов оказалась завалена названиями продуктов, их классификацией, сравнением, что суть вещей оказалась погребена под этим слоем мусора.
Кислый и основной оксид алюминия - это классификация коммерческих продуктов, которой не существовало еще каких-то 50 лет назад, а сегодня этот сорбент уже и забыт вовсе. Подобная ситуация с обратной фазой: мы хорошо знаем коммерческие колонки, но мало кто знает, как их делать, и совсем единицы знают, в чем их преимущества над целым спектром других обратных фаз, коих хорошо изученных существует весьма немало.
Я могу задать очень простой вопрос, на который 95% профессоров и докторов ничего не смогут внятного ответить: почему немодифицированный силикагель оказался наиболее распространенной фазой в хроматографии? У меня самого не так много аргументов по этой теме, но они у меня хотя бы есть.
Мэчри-нагель и Мерк продают и банками Al2O3, и в колонках, и на тонких слоях, этот сорбент не столько забыт, сколько имеет узкое применение и плохо поддается модификации (не алкилируешь, не обратишь), ведь коммерческих вариантов силикагеля очень много с разными группами и разной формы, а Al2O3 - по пальцам пересчитать.
>хуйня с 4 положительно заряженными пиридиниевыми центрами будет в этой системе бодро ползти вверх на обычной силикагельной пластине
Influence of the hofmeister series on the retention of amines in reversed-phase liquid chromatography - https://www.ncbi.nlm.nih.gov/pubmed/12380814
Соли гексафторфосфатов аминов сильно задерживаются обратной фазой, и, по логике, слабо задерживаются прямой фазой.
А система интересная, да.
>Ты меня, конечно, удивил - я не ожидал, что пропитка вазелином так хорошо работает
Я вообще сам себя удивил. В последнее время регулярно удивляюсь, потому что вне книжек, оказывается, есть целый мир. К сожалению, ты тоже в сфере хроматографии демонстрируешь книжные знания, что меня печалит, потому что наверняка есть много малоизвестных знаний, которые мне придется продолжать самостоятельно копать.
>Разные виды окиси кремния, цеолиты, окись титана всех видов, окись алюминия, церия, и всего прочего.
Я недавно синтезировал молекулярные сита, которые Linde Type A, и был удивлен тому, что это, оказывается, мелкий порошок из кубиков микрометровых размеров, которые еле видны в оптический микроскоп. А также неприятно удивлен тому факту, что сита 3Å фактически никто не продает, хотя в название "3Å" лепят. В лучшем случае это 4Å, в худшем - просто глина. Приходится заказывать у импортеров авторитетных марок.
>любой органик скрючит рожу от перспективы делить что-нибудь на колонке в системе с метанолом
Эффектами изменения сорбента метанолом можно и нужно пользоваться. Где-то очень давно встречал сравнение зависимости разделяемости веществ от состава подвижной фазы, где показывалось, что метанол-хлороформ делит лучше, чем чистый хлороформ или хлороформ с этилацетатом. Там были красивые графики, которые показывают зависимость Rf двух веществ от состава растворителя, и видно, что смешанные разнородные растворители делят лучше, чем каждый из них по отдельности или однородные любого состава. Я тогда сразу не понял ценность информации, потому не схоронил.
>метанол ещё отлично вымывает силикагель из колонки. Если метанола в системе много, на выходе получишь продукт вперемешку с силикагелем, даже если внизу колонны хороший слой песка.
http://www.flash-purification.com/does-methanol-really-dissolve-silica-during-flash-column-chromatography/ - Does methanol really dissolve silica during flash column chromatography?
https://chemtips.wordpress.com/2013/02/01/is-silica-soluble-in-methanol/ - Is Silica Soluble in Methanol?
Действительно вымывает, но только из острогранного силикагеля и только мельчайшие обломки. Даже вода сама по себе не вымывает, она просто химически изменяет силикагель и он рассыпается.
>Оксид алюминия - это забытое искусство предков. В целом, его три основных категории: кислый, нейтральный, и основной
Вот, это книжное знание. На самом деле бывает единственный оксид алюминия - нейтральный, остальные - это его модификации.
У меня складывается ощущение, что эта сфера под давление коммерсантов оказалась завалена названиями продуктов, их классификацией, сравнением, что суть вещей оказалась погребена под этим слоем мусора.
Кислый и основной оксид алюминия - это классификация коммерческих продуктов, которой не существовало еще каких-то 50 лет назад, а сегодня этот сорбент уже и забыт вовсе. Подобная ситуация с обратной фазой: мы хорошо знаем коммерческие колонки, но мало кто знает, как их делать, и совсем единицы знают, в чем их преимущества над целым спектром других обратных фаз, коих хорошо изученных существует весьма немало.
Я могу задать очень простой вопрос, на который 95% профессоров и докторов ничего не смогут внятного ответить: почему немодифицированный силикагель оказался наиболее распространенной фазой в хроматографии? У меня самого не так много аргументов по этой теме, но они у меня хотя бы есть.
Мэчри-нагель и Мерк продают и банками Al2O3, и в колонках, и на тонких слоях, этот сорбент не столько забыт, сколько имеет узкое применение и плохо поддается модификации (не алкилируешь, не обратишь), ведь коммерческих вариантов силикагеля очень много с разными группами и разной формы, а Al2O3 - по пальцам пересчитать.
>хуйня с 4 положительно заряженными пиридиниевыми центрами будет в этой системе бодро ползти вверх на обычной силикагельной пластине
Influence of the hofmeister series on the retention of amines in reversed-phase liquid chromatography - https://www.ncbi.nlm.nih.gov/pubmed/12380814
Соли гексафторфосфатов аминов сильно задерживаются обратной фазой, и, по логике, слабо задерживаются прямой фазой.
А система интересная, да.
 74 Кб, 1080x721
74 Кб, 1080x721Есть банка, в банке 85% спирт, в котором настаиваются травы. Эфирные масла короч из трав экстрагируются.
Банки пластиковыми крышками закупорены. Вчера подумал, что пластиковые крышки будут с парами спирта реагировать и вместо них фольгой банки закупорил.
Так вот вопрос. Что хуже - пластиковые крышки или фольга? Чем банки закупорить, чтобы с парами спирта не реагировало и чтобы эфирные масла не выветривались???
пикрандом
Де я его возьму. Из окна вырезать?
 32 Кб, 800x419
32 Кб, 800x419Вопрос решен.
>Я недавно синтезировал молекулярные сита, которые Linde Type A, и был удивлен тому, что это, оказывается, мелкий порошок из кубиков микрометровых размеров, которые еле видны в оптический микроскоп.
Ну да. Большинство методов синтеза цеолитов в результате даёт мелкокристаллический порошок, порой специально пытаются получить "нанокристаллы" - некоторые области применения цеолитов требуют не только наличие пор, но и развитой поверхности.
>А также неприятно удивлен тому факту, что сита 3Å фактически никто не продает, хотя в название "3Å" лепят. В лучшем случае это 4Å, в худшем - просто глина. Приходится заказывать у импортеров авторитетных марок.
А как ты это определял, если не секрет? Изотерму адсорбции азота измерял? Очень категоричное заявление, я надеюсь у тебя есть хорошие пруфы.
>смешанные разнородные растворители делят лучше, чем каждый из них по отдельности или однородные любого состава
Это часто наблюдается, с разными системами растворителей. К метанолу претензия была совершенно другого рода: он очень сильно уменьшает ёмкость колонки. Может на ТСХ пятна действительно неплохо разделяются, но вот на практике гнать препаративную колонку в системе "хлороформ/метанол" гораздо утомительнее, чем в системе "этилацетат/гексан".
>Действительно вымывает, но только из острогранного силикагеля и только мельчайшие обломки
Опять-таки, это чисто практическое наблюдение. Обычный хроматографический силикагель, на котором делится 99% всякого говна в типичной органической лабе.
>На самом деле бывает единственный оксид алюминия - нейтральный, остальные - это его модификации.
Очень странное утверждение, если честно. Как говорится, "на самом деле самого дела нет". Так можно договориться до того, что и химии на самом деле никакой нет, ибо всё есть электроны, протоны и нейтроны. Ты, разумеется, прав в том, что кислая и основная окись алюминия делаются из нейтральной. Но отличие между этими разновидностями огромное, так как обработка сильно меняет структуру повехностного слоя, который и определяет основные свойства сорбента. По сути, подобная обработка меняет свойства не сильно меньше, чем навешивание каких-то функциональных групп на силикагель.
>Я могу задать очень простой вопрос, на который 95% профессоров и докторов ничего не смогут внятного ответить: почему немодифицированный силикагель оказался наиболее распространенной фазой в хроматографии?
Я, пожалуй, сознательно и добровольно присоединюсь к 95% незнающих. Ибо "знающие наверняка" обычно встречаются в церкви, а не в науке. Ты постулируешь существование какой-то главной и абсолютной причины, по которой обычный силикагель стал основным сорбентом в лабораторной практике. По сути, миллионы людей под действием разных обстоятельств сделали свой выбор, но ты почему-то решил, что была какая-то единственная и истинно верная причина. Силикагель, пожалуй, просто удовлетворил большинство критериев - он дешёвый, отлично работает для 99% "обычных" сценариев органической химии, широко доступный, нетоксичный (если им не дышать), безвредный для окружающей среды. Окись алюминия в общем-то тоже годится для большинства органических задач - там не зря придумали не только "кислотность", но и "активность", которая определяется добавлением воды. Но зачем экспериментировать с разными типами и активностями окиси алюминия, если можно просто использовать силикагель из одной и той же банки для большинства задач?
>книжные знания
Не знаю, почему ты так агришься на книжные знания. Разумеется, там не всё является истиной, и практический опыт не заменишь ничем, но доступность сконцентрированных знаний здесь и сейчас, без долгих лет набивания шишек на личном опыте, может быть великим благом.
>Я недавно синтезировал молекулярные сита, которые Linde Type A, и был удивлен тому, что это, оказывается, мелкий порошок из кубиков микрометровых размеров, которые еле видны в оптический микроскоп.
Ну да. Большинство методов синтеза цеолитов в результате даёт мелкокристаллический порошок, порой специально пытаются получить "нанокристаллы" - некоторые области применения цеолитов требуют не только наличие пор, но и развитой поверхности.
>А также неприятно удивлен тому факту, что сита 3Å фактически никто не продает, хотя в название "3Å" лепят. В лучшем случае это 4Å, в худшем - просто глина. Приходится заказывать у импортеров авторитетных марок.
А как ты это определял, если не секрет? Изотерму адсорбции азота измерял? Очень категоричное заявление, я надеюсь у тебя есть хорошие пруфы.
>смешанные разнородные растворители делят лучше, чем каждый из них по отдельности или однородные любого состава
Это часто наблюдается, с разными системами растворителей. К метанолу претензия была совершенно другого рода: он очень сильно уменьшает ёмкость колонки. Может на ТСХ пятна действительно неплохо разделяются, но вот на практике гнать препаративную колонку в системе "хлороформ/метанол" гораздо утомительнее, чем в системе "этилацетат/гексан".
>Действительно вымывает, но только из острогранного силикагеля и только мельчайшие обломки
Опять-таки, это чисто практическое наблюдение. Обычный хроматографический силикагель, на котором делится 99% всякого говна в типичной органической лабе.
>На самом деле бывает единственный оксид алюминия - нейтральный, остальные - это его модификации.
Очень странное утверждение, если честно. Как говорится, "на самом деле самого дела нет". Так можно договориться до того, что и химии на самом деле никакой нет, ибо всё есть электроны, протоны и нейтроны. Ты, разумеется, прав в том, что кислая и основная окись алюминия делаются из нейтральной. Но отличие между этими разновидностями огромное, так как обработка сильно меняет структуру повехностного слоя, который и определяет основные свойства сорбента. По сути, подобная обработка меняет свойства не сильно меньше, чем навешивание каких-то функциональных групп на силикагель.
>Я могу задать очень простой вопрос, на который 95% профессоров и докторов ничего не смогут внятного ответить: почему немодифицированный силикагель оказался наиболее распространенной фазой в хроматографии?
Я, пожалуй, сознательно и добровольно присоединюсь к 95% незнающих. Ибо "знающие наверняка" обычно встречаются в церкви, а не в науке. Ты постулируешь существование какой-то главной и абсолютной причины, по которой обычный силикагель стал основным сорбентом в лабораторной практике. По сути, миллионы людей под действием разных обстоятельств сделали свой выбор, но ты почему-то решил, что была какая-то единственная и истинно верная причина. Силикагель, пожалуй, просто удовлетворил большинство критериев - он дешёвый, отлично работает для 99% "обычных" сценариев органической химии, широко доступный, нетоксичный (если им не дышать), безвредный для окружающей среды. Окись алюминия в общем-то тоже годится для большинства органических задач - там не зря придумали не только "кислотность", но и "активность", которая определяется добавлением воды. Но зачем экспериментировать с разными типами и активностями окиси алюминия, если можно просто использовать силикагель из одной и той же банки для большинства задач?
>книжные знания
Не знаю, почему ты так агришься на книжные знания. Разумеется, там не всё является истиной, и практический опыт не заменишь ничем, но доступность сконцентрированных знаний здесь и сейчас, без долгих лет набивания шишек на личном опыте, может быть великим благом.
Такое дело, очень нужна помощь и прошу откликнуться тех, кто сможет. Сегодня (18 июня) в 13:00 у меня экзамен по химии (1 курс тех.ВУЗа). Учусь по специальности, где химия — вероятно, последнее, что нужно, т.е. вообще не мой профиль. Помогите на экзамене, пожалуйста.
В билете 1 теоретический вопрос и 3 практических, (неорганика, органической химии не будет) с теорией справлюсь, а вот с практикой — навряд ли. Напишите здесь, если сможете, свяжемся в телеграмме или где вам будет удобно. Я знаю, что вы не равнодушные и хорошие люди, выручайте, у меня больше не к кому обратиться.
 46 Кб, 600x303
46 Кб, 600x303Орнул че-т)
А кто мне за талую воду пояснить?
Действительно воду так можно очистить? Набрать в баночку, в холодильник поставить, потом слить соленый раствор и взять чистый лед, который чище дистиллированной воды.
Я вот гуглить пытаюсь, и везде где воду вымораживают, пишут что мало того, что она чистая, так еще и СТРУКТУРИРОВАННАЯ становится. Подобная ересь заставлять усомниться в достоверности информации.
>441080
Почему-то на другой ответ и не рассчитывал.
Но нет, твои надежды не будут оправданы, поскольку из моего института сложно вылетать, хех. И тебе добра.
>А как ты это определял, если не секрет? Изотерму адсорбции азота измерял? Очень категоричное заявление, я надеюсь у тебя есть хорошие пруфы.
Ну мне не площадь поверхности же измерять, потому не азота, а этанол-водной смеси. Всю изотерму я забусь измерять, брал две точки, за опорные брались сведения отсюда:
http://dx.doi.org/10.1590/S0104-66321997000300004 - Ethanol-Water adsorption on commercial 3A zeolites: kinetic and thermodynamic data
Метанол-водную неудобны, потому что метанол стоит на самой границе избирательности сит.
На последних 4% для этанол-воды зависимость почти линейная, так что, грубо говоря, при конечной концентрации 98% этанола и температуре 25 С каждый грамм сит должен адсорбировать 0.07-0.10 г воды в равновесии. У меня на одном продажном "цеолите" в области 97-98% получались цифры менее 0.01 г/г, на другом 0.02-0.03 г/г, последняя цифра характерна для 4Å, первая цифра находится где-то на уровне эффективности такого осушителя, как соль поваренная "Экстра".
Примечательно, что отечественные химики настолько привыкли к этому положению вещей, что всерьез рекомендуют для "3Å цеолитов" кидать осушителя больше, чем спирта.
Или ты хотел сказать, что мне надо было бы измерить площадь поверхности, чтобы выяснить, какая у него общая емкость, и потом соотносить с избирательным поглощением? Мне это как-то даже не приходило в голову, а если бы и пришло, то было бы лень заморачиваться самому на фоне вышеупомянутых ужасных результатов.
Для первых цеолитов я только измерил общий объем пор, 0.3 мл на 1 г.
>кислая и основная окись алюминия делаются из нейтральной. Но отличие между этими разновидностями огромное, так как обработка сильно меняет структуру повехностного слоя, который и определяет основные свойства сорбента. По сути, подобная обработка меняет свойства не сильно меньше, чем навешивание каких-то функциональных групп на силикагель.
Да, это и есть функциональные группы. Например, промывка нейтральной окиси алюминия нитратом аммония приводит к превращению сорбента в кислую форму, которая стабильна при промывании дистиллированной водой. Очевидно, происходит это за счет химической модификации.
По-твоему, если бы я сказал "я разделял вещества на силикагеле" - тебе бы пришло в голову, что я использовал силанизированный силикагель? Но почему, ведь силанизированный силикагель - это тоже силикагель, просто немного измененный. И модифицированный до неузнаваемости оксид алюминия кому-то приходит в голову называть просто "окись алюминия".
>можно просто использовать силикагель из одной и той же банки для большинства задач
Вот, а говоришь не знаешь причину. Потому последние десятилетия и идет уклон в повышение эффективности, а не избирательности - чтобы одну и ту же колонку использовать для всего.
>нетоксичный (если им не дышать)
Им и дышать безопасно, вроде, если в небольшой концентрации.
>Окись алюминия в общем-то тоже годится для большинства органических задач - там не зря придумали не только "кислотность", но и "активность", которая определяется добавлением воды
Именно поэтому окись алюминия не прижилась - очень узкое применение в органике. В статьях научных часто не описывается ширина полосы и асимметрия, иначе было бы хорошо видно, насколько порой ужасен результат на используемом сорбенте.
>книжные знания
>там не всё является истиной, и практический опыт не заменишь ничем, но доступность сконцентрированных знаний здесь и сейчас, без долгих лет набивания шишек на личном опыте, может быть великим благом
Де-факто уровень книжек зачастую настолько низкий, что они дают ощущение ложных знаний, мешающих узнавать реальность.
Вот ты знаешь книжку вогеля? Он же писал ее на базе многочисленных практических опытов. Но даже там есть серьезные недочеты описаний, хотя все описанные процедуры при повторении 1 в 1 дадут какой-то ненулевой результат.
А теперь представь, какой пиздец происходит в книге, написанной человеком, который большинство описанных методов сам не проверял и не знает людей, кототорые бы проверяли их. И ведь 95% книг написаны именно так, и еще хорошо, если автор честно признается, как я недавно читал на одном из форумов, где чел задал вопрос автору книги по электропочте, а в ответ получил "мопед не мой, я просто разместил объяву. Ищите того, кто проверял экспериментально". В итоге мы имеем информационный шум, на фоне которого настоящую инфу найти весьма тяжело. Особенно, особенно это актуально для области хроматографии, где разбирающихся экспертов можно пересчитать по пальцам, а книг пишется в 100 раз больше, чем существует этих самых экспертов.
В итоге шишки придется набивать, с книжками или без, разница лишь в том, что с книжкой у тебя будет стартовая позиция, настолько же полезная, как и любая другая позиция. Как я писал, у меня есть стойкое впечатление, что это используется в коммерческих целях, чтобы люди первым делом бежали покупать продукцию Мерска, а потом уже может быть узнавали об альтернативах.
>А как ты это определял, если не секрет? Изотерму адсорбции азота измерял? Очень категоричное заявление, я надеюсь у тебя есть хорошие пруфы.
Ну мне не площадь поверхности же измерять, потому не азота, а этанол-водной смеси. Всю изотерму я забусь измерять, брал две точки, за опорные брались сведения отсюда:
http://dx.doi.org/10.1590/S0104-66321997000300004 - Ethanol-Water adsorption on commercial 3A zeolites: kinetic and thermodynamic data
Метанол-водную неудобны, потому что метанол стоит на самой границе избирательности сит.
На последних 4% для этанол-воды зависимость почти линейная, так что, грубо говоря, при конечной концентрации 98% этанола и температуре 25 С каждый грамм сит должен адсорбировать 0.07-0.10 г воды в равновесии. У меня на одном продажном "цеолите" в области 97-98% получались цифры менее 0.01 г/г, на другом 0.02-0.03 г/г, последняя цифра характерна для 4Å, первая цифра находится где-то на уровне эффективности такого осушителя, как соль поваренная "Экстра".
Примечательно, что отечественные химики настолько привыкли к этому положению вещей, что всерьез рекомендуют для "3Å цеолитов" кидать осушителя больше, чем спирта.
Или ты хотел сказать, что мне надо было бы измерить площадь поверхности, чтобы выяснить, какая у него общая емкость, и потом соотносить с избирательным поглощением? Мне это как-то даже не приходило в голову, а если бы и пришло, то было бы лень заморачиваться самому на фоне вышеупомянутых ужасных результатов.
Для первых цеолитов я только измерил общий объем пор, 0.3 мл на 1 г.
>кислая и основная окись алюминия делаются из нейтральной. Но отличие между этими разновидностями огромное, так как обработка сильно меняет структуру повехностного слоя, который и определяет основные свойства сорбента. По сути, подобная обработка меняет свойства не сильно меньше, чем навешивание каких-то функциональных групп на силикагель.
Да, это и есть функциональные группы. Например, промывка нейтральной окиси алюминия нитратом аммония приводит к превращению сорбента в кислую форму, которая стабильна при промывании дистиллированной водой. Очевидно, происходит это за счет химической модификации.
По-твоему, если бы я сказал "я разделял вещества на силикагеле" - тебе бы пришло в голову, что я использовал силанизированный силикагель? Но почему, ведь силанизированный силикагель - это тоже силикагель, просто немного измененный. И модифицированный до неузнаваемости оксид алюминия кому-то приходит в голову называть просто "окись алюминия".
>можно просто использовать силикагель из одной и той же банки для большинства задач
Вот, а говоришь не знаешь причину. Потому последние десятилетия и идет уклон в повышение эффективности, а не избирательности - чтобы одну и ту же колонку использовать для всего.
>нетоксичный (если им не дышать)
Им и дышать безопасно, вроде, если в небольшой концентрации.
>Окись алюминия в общем-то тоже годится для большинства органических задач - там не зря придумали не только "кислотность", но и "активность", которая определяется добавлением воды
Именно поэтому окись алюминия не прижилась - очень узкое применение в органике. В статьях научных часто не описывается ширина полосы и асимметрия, иначе было бы хорошо видно, насколько порой ужасен результат на используемом сорбенте.
>книжные знания
>там не всё является истиной, и практический опыт не заменишь ничем, но доступность сконцентрированных знаний здесь и сейчас, без долгих лет набивания шишек на личном опыте, может быть великим благом
Де-факто уровень книжек зачастую настолько низкий, что они дают ощущение ложных знаний, мешающих узнавать реальность.
Вот ты знаешь книжку вогеля? Он же писал ее на базе многочисленных практических опытов. Но даже там есть серьезные недочеты описаний, хотя все описанные процедуры при повторении 1 в 1 дадут какой-то ненулевой результат.
А теперь представь, какой пиздец происходит в книге, написанной человеком, который большинство описанных методов сам не проверял и не знает людей, кототорые бы проверяли их. И ведь 95% книг написаны именно так, и еще хорошо, если автор честно признается, как я недавно читал на одном из форумов, где чел задал вопрос автору книги по электропочте, а в ответ получил "мопед не мой, я просто разместил объяву. Ищите того, кто проверял экспериментально". В итоге мы имеем информационный шум, на фоне которого настоящую инфу найти весьма тяжело. Особенно, особенно это актуально для области хроматографии, где разбирающихся экспертов можно пересчитать по пальцам, а книг пишется в 100 раз больше, чем существует этих самых экспертов.
В итоге шишки придется набивать, с книжками или без, разница лишь в том, что с книжкой у тебя будет стартовая позиция, настолько же полезная, как и любая другая позиция. Как я писал, у меня есть стойкое впечатление, что это используется в коммерческих целях, чтобы люди первым делом бежали покупать продукцию Мерска, а потом уже может быть узнавали об альтернативах.
Так как морская вода солёная, замерзание воды с солёностью, равной средней солёности
Мирового океана, происходит при температуре около −1,8 °C.
Сама же, дистиллированная вода - замерзает при 0 цельсия,
поэтому когда морозишь солёную воду - в первую очередь
кристаллизируются кристаллы льда и повышается концентрация соли
в незамороженном растворе.
>Ну мне не площадь поверхности же измерять, потому не азота, а этанол-водной смеси
Во-первых, синтез 3Å сит из 4Å очень простой - натрий в структуре меняется на калий. Тупо катионный обмен. Конкретно превращение из 4Å в 3Å я не осуществлял, но мы постоянно меняем катионы в разных алюмосиликатных цеолитах, это крайне незамысловатый процесс. Во-вторых, мне сложно представить, что в стране со столь развитой нефтегазовой отраслью нет качественного 3Å цеолита. Всё-таки покупатели из нефтянки гораздо требовательнее, чем ты. У них банально большое бабло на кону, им хуёвый продукт не впаришь. Думаю, твоя проблема на 99% в кинетике, или в неправильной сушке цеолита. Как ты его активировал, кстати? Цеолит не слишком сложно испортить, например, перегрев при сушке. Есть существенные причины, по которым для подобных исследований предпочтительнее использовать азот - он не взаимодействует с самим материалом, и пролезает практически в любую дырку. Изотерма адсорбции азота содержит глубоко зарытую информацию о распределении размера пор, так что для твоего вопроса я тебе рекомендую классический BET с азотом при 77К.
>всерьез рекомендуют для "3Å цеолитов" кидать осушителя больше, чем спирта
В буржуйских лабах бытует аналогичное поверье. Дефолтный выбор - 4Å, и только если необходим конкретно 3Å, то берут его, и по возможности меняют несколько раз.
>По-твоему, если бы я сказал "я разделял вещества на силикагеле" - тебе бы пришло в голову, что я использовал силанизированный силикагель?
Ну вот в моей органической лабе стояла одна бочка с силикагелем, и все были довольны. Сейчас я работаю в лабе, в которой есть полсотни разных силикагелей, из которых активно используется где-то 5-10 видов. Органик бы не парясь смешал всё вместе, и зарядил бы колонку. А для наших целей различия критичны. Я бы сформулировал это так: химическая номенклатура довольно хорошо работает для небольших молекул. А вот выше какого-то уровня, начинается форменный пиздец, где название не содержит достаточного количества информации для отображения структуры, и два разных "силикагеля" могут вести себя совершенно идентично в одних задачах, и по-разному в каких-то других.
>Им и дышать безопасно, вроде, если в небольшой концентрации.
Более того, я когда-то работал над проектом, в котором мезопористый сферический силикагель задумывался именно для вдыхания, доставлять противотуберкулёзные препараты прямо по адресу. Претензий со стороны ФДА не было, generally recognized as safe. Другое дело, что в обычном силикагеле скорее всего будет какой-то небольшой процент кристаллического кварца. И вот этот процент в старости может заявить о себе.
>Именно поэтому окись алюминия не прижилась - очень узкое применение в органике
Я бы не сказал, что именно узкое - на ней когда-то делили всё подряд, что не могли перегнать, или перекристаллизовать. Скорее, просто ненужный геморрой на ровном месте, когда есть более удобные и универсальные сорбенты.
>Де-факто уровень книжек зачастую настолько низкий, что они дают ощущение ложных знаний, мешающих узнавать реальность.
Ты, разумеется, прав. Но ты попробуй пойти, и сделать лучше, лол. Особенно в условиях современной западной науки, где непрекращающимся потоком тебе ебут мозги необходимостью публиковать, писать бессмысленные гранты с 10% вероятностью получить бабло, продвигать чёрных гомосексуальных женщин в науке, и выполнять прочие религиозные ритуалы. Я, например, посмотрев на эту кухню, проникся глубоким уважением к тем, кто способен в этих условиях публиковать хоть что-то, состоящее из говна не на 100, а всего лишь на 50%. Химикам бы запилить своего рода гитхаб, где можно пул реквесты делать, и багрепорты писать. Где люди бы работали ради какой-то общей цели, создавать более или менее объективную картину мира. Но пока главный девиз в химии - наеби ближнего своего, и при возможности плюнь ему в колбу.
>Ну мне не площадь поверхности же измерять, потому не азота, а этанол-водной смеси
Во-первых, синтез 3Å сит из 4Å очень простой - натрий в структуре меняется на калий. Тупо катионный обмен. Конкретно превращение из 4Å в 3Å я не осуществлял, но мы постоянно меняем катионы в разных алюмосиликатных цеолитах, это крайне незамысловатый процесс. Во-вторых, мне сложно представить, что в стране со столь развитой нефтегазовой отраслью нет качественного 3Å цеолита. Всё-таки покупатели из нефтянки гораздо требовательнее, чем ты. У них банально большое бабло на кону, им хуёвый продукт не впаришь. Думаю, твоя проблема на 99% в кинетике, или в неправильной сушке цеолита. Как ты его активировал, кстати? Цеолит не слишком сложно испортить, например, перегрев при сушке. Есть существенные причины, по которым для подобных исследований предпочтительнее использовать азот - он не взаимодействует с самим материалом, и пролезает практически в любую дырку. Изотерма адсорбции азота содержит глубоко зарытую информацию о распределении размера пор, так что для твоего вопроса я тебе рекомендую классический BET с азотом при 77К.
>всерьез рекомендуют для "3Å цеолитов" кидать осушителя больше, чем спирта
В буржуйских лабах бытует аналогичное поверье. Дефолтный выбор - 4Å, и только если необходим конкретно 3Å, то берут его, и по возможности меняют несколько раз.
>По-твоему, если бы я сказал "я разделял вещества на силикагеле" - тебе бы пришло в голову, что я использовал силанизированный силикагель?
Ну вот в моей органической лабе стояла одна бочка с силикагелем, и все были довольны. Сейчас я работаю в лабе, в которой есть полсотни разных силикагелей, из которых активно используется где-то 5-10 видов. Органик бы не парясь смешал всё вместе, и зарядил бы колонку. А для наших целей различия критичны. Я бы сформулировал это так: химическая номенклатура довольно хорошо работает для небольших молекул. А вот выше какого-то уровня, начинается форменный пиздец, где название не содержит достаточного количества информации для отображения структуры, и два разных "силикагеля" могут вести себя совершенно идентично в одних задачах, и по-разному в каких-то других.
>Им и дышать безопасно, вроде, если в небольшой концентрации.
Более того, я когда-то работал над проектом, в котором мезопористый сферический силикагель задумывался именно для вдыхания, доставлять противотуберкулёзные препараты прямо по адресу. Претензий со стороны ФДА не было, generally recognized as safe. Другое дело, что в обычном силикагеле скорее всего будет какой-то небольшой процент кристаллического кварца. И вот этот процент в старости может заявить о себе.
>Именно поэтому окись алюминия не прижилась - очень узкое применение в органике
Я бы не сказал, что именно узкое - на ней когда-то делили всё подряд, что не могли перегнать, или перекристаллизовать. Скорее, просто ненужный геморрой на ровном месте, когда есть более удобные и универсальные сорбенты.
>Де-факто уровень книжек зачастую настолько низкий, что они дают ощущение ложных знаний, мешающих узнавать реальность.
Ты, разумеется, прав. Но ты попробуй пойти, и сделать лучше, лол. Особенно в условиях современной западной науки, где непрекращающимся потоком тебе ебут мозги необходимостью публиковать, писать бессмысленные гранты с 10% вероятностью получить бабло, продвигать чёрных гомосексуальных женщин в науке, и выполнять прочие религиозные ритуалы. Я, например, посмотрев на эту кухню, проникся глубоким уважением к тем, кто способен в этих условиях публиковать хоть что-то, состоящее из говна не на 100, а всего лишь на 50%. Химикам бы запилить своего рода гитхаб, где можно пул реквесты делать, и багрепорты писать. Где люди бы работали ради какой-то общей цели, создавать более или менее объективную картину мира. Но пока главный девиз в химии - наеби ближнего своего, и при возможности плюнь ему в колбу.
Другим словом, способ рабочий и так можно воду чище дистиллята сделать?
Чому в зарубежном Интернете этот способ очистки практически не гуглится?
Та вода не будет чище дистиллята. Так из морской воды можно получить питьевую, только и всего.
>не будет чище дистиллята
если раза три так поделать,то еще как будет. либо разница будет очень маленькой
 248 Кб, 936x526
248 Кб, 936x526Сушил цеолит где-то около 250 С пару часов.
Что должен показать классический BET? Что у моих цеолитов большая поверхность глины? А чтобы рассмотреть эффект микропор, нужно точное измерение наклона кривой, при этом гелий дает уже другие результаты. Потому все-таки обычно либо используют измерение адсорбции разных газов, либо рентгеновскую дифракцию.
>>Именно поэтому окись алюминия не прижилась - очень узкое применение в органике
>Я бы не сказал, что именно узкое - на ней когда-то делили всё подряд, что не могли перегнать, или перекристаллизовать. Скорее, просто ненужный геморрой на ровном месте, когда есть более удобные и универсальные сорбенты.
Эй, погоди, когда это делили все подряд? Я вот смотрю книгу шталя 1966-1969 годов, там в основном силикагель. К слову, я нашел хорошую картинку, которая иллюстрирует недостатки оксида алюминия: чуть меньше загрузка, и уже ничего не видно, чуть больше - и поползли слизни по пластинке. Пикча из статьи:
https://doi.org/10.1016/S0021-9673(01)83670-0 - Thin-layer chromatography of aliphatic 2,4-dinitrophenylhydrazones
>Ты, разумеется, прав. Но ты попробуй пойти, и сделать лучше, лол.
"Хуесоса критиковать может каждый. Но ты попробуй сам пососать хуи" - я решил этот вопрос легко: книжки не нужны. Я не читаю книжки не то что целиком, но даже не помню, когда в последний раз целиком прочитал одну главу. Уже очень давно книги потеряли ту функцию, которую они выполняли еще 100-200 лет назад, когда получать знания было тяжело.
Было бы прикольно создать сообщество научных проектов, но проблема мудаков в нем будет труднорешаема. Вон, в википедие какой пиздец творится: как определить, кто адекват, а кто нет?
Слава богу хоть немного разобрались с охуевшими издательствами, которые не дают доступа к научным статьям и книгам, и теперь солидная часть научных исследований есть в открытом доступе. С книжками ситуация сложнее: многие из них уже давно оцифрованы, но издательства не разрешают публиковать эти копии, а организации, которые хранят эти книжки, нарушать законы не спешат, в отличие от сцай-хаба, где владелица в рот ебала копирайтеров.
 248 Кб, 936x526
248 Кб, 936x526Сушил цеолит где-то около 250 С пару часов.
Что должен показать классический BET? Что у моих цеолитов большая поверхность глины? А чтобы рассмотреть эффект микропор, нужно точное измерение наклона кривой, при этом гелий дает уже другие результаты. Потому все-таки обычно либо используют измерение адсорбции разных газов, либо рентгеновскую дифракцию.
>>Именно поэтому окись алюминия не прижилась - очень узкое применение в органике
>Я бы не сказал, что именно узкое - на ней когда-то делили всё подряд, что не могли перегнать, или перекристаллизовать. Скорее, просто ненужный геморрой на ровном месте, когда есть более удобные и универсальные сорбенты.
Эй, погоди, когда это делили все подряд? Я вот смотрю книгу шталя 1966-1969 годов, там в основном силикагель. К слову, я нашел хорошую картинку, которая иллюстрирует недостатки оксида алюминия: чуть меньше загрузка, и уже ничего не видно, чуть больше - и поползли слизни по пластинке. Пикча из статьи:
https://doi.org/10.1016/S0021-9673(01)83670-0 - Thin-layer chromatography of aliphatic 2,4-dinitrophenylhydrazones
>Ты, разумеется, прав. Но ты попробуй пойти, и сделать лучше, лол.
"Хуесоса критиковать может каждый. Но ты попробуй сам пососать хуи" - я решил этот вопрос легко: книжки не нужны. Я не читаю книжки не то что целиком, но даже не помню, когда в последний раз целиком прочитал одну главу. Уже очень давно книги потеряли ту функцию, которую они выполняли еще 100-200 лет назад, когда получать знания было тяжело.
Было бы прикольно создать сообщество научных проектов, но проблема мудаков в нем будет труднорешаема. Вон, в википедие какой пиздец творится: как определить, кто адекват, а кто нет?
Слава богу хоть немного разобрались с охуевшими издательствами, которые не дают доступа к научным статьям и книгам, и теперь солидная часть научных исследований есть в открытом доступе. С книжками ситуация сложнее: многие из них уже давно оцифрованы, но издательства не разрешают публиковать эти копии, а организации, которые хранят эти книжки, нарушать законы не спешат, в отличие от сцай-хаба, где владелица в рот ебала копирайтеров.
>классический BET?
от цеолита зависит вообще-то.
можешь заказать - тебе померяют за деньги твой бет на хорошем приборе.
мимо оператор прибора
из чего?
Посмотри в ютубе, как растят кристаллы,
сделай центр кристаллизации в солёной воде,
а потом промоешь во вне.
Без медного купороса воду не почистить? Что если его железным купоросом заменить? У меня только железный есть.
Доебали уже этими выращиваниями кристаллов. Каждый ютубо-химик обязательно хоть раз, но эту хуиту покажет на своем канале. Да и мне не кристаллы выращивать, а воду почистить. Стенки посуды вполне должны сгодиться как центры кристаллизации.
Причём тут купорос, ты посмотри как кристаллы растут.
Наливаешь воду эту свою солёную, и ставишь в морозилку, и растишь эти свои кристаллы льда. Потом промываешь.
http://chem21.info/info/1452163/
На кой черт в 21 веке нужны все эти полные дифференциалы, когда любая связь в молекуле элементарно высчитывается гауссианом?
Классическая термодинамика не работает с системами, в которых меньше 109 частиц. А статистическая термодинамика внутреннюю энергию газов и энтропию умеет без всяких гамильтонианов считать.
Как только ты сможешь загнать в Гауссиан содержимое всей колбы а не три молекулы в газовой фазе, и прогнать кучу динамических симуляций для адекватной статистики, мы с удовольствием перестанем пользоваться никому уже не нужным понятием энтропии.
например, уксусная кислота
Из PiHKAL конечно же
В его синтезаторе.
Есть, но другие окислители достать ещё сложнее.
 65 Кб, 744x744
65 Кб, 744x744Привет, двач! Интересует следующий вопрос:
Протоны и нейтроны в ядре состоят из кварков. (каждый по три кварка).
Протон имеет структуру из одного d-кварка и двух u-кварков.
Нейтрон имеет структуру из двух d-кварков и одного u-кварка.
Протоны и нейтроны называются нуклонами.
Собственно вопрос: а могут ли быть нуклоны из трех одинаковых кварков(из трех d-кварков или трех u-кварков)?
>(каждый по три кварка)
Не по три кварка, а по три вида кварков. А кварков там в нуклонах хуйтильон.
 13 Кб, 663x362
13 Кб, 663x362По процентажу кислорода(элемента) определить оксид. Это классическая задача, которая будет встречаться почти в каждой третьей задаче, чуть ли не вплоть до межнара.
Решается она обычно так.
Принимаешь формулу оксида как ЭxOy
Какое массовое отношение у кислорода и элемента? Ну вот с одной стороны
M(металла)x/16y
C другой стороны w=88.15 и поэтому w/(100-w)
Получаем M=16w/(100-w) y/x = 119,02 y/x
Ну и всё, теперь просто перебери формулы оксидов Э2О ЭО Э2О3 ЭО2 Э2О5 и т.п У тебя в них y/x = 0.5 1 1.5 2 2.5
Конкретно в этом случае у тебя подходят только SnO и UO2 и Hf2O3 тут надо посмотреть на другие оксиды и выбрать. Но вообще по тону задачи, напрашивается сразу уран.
А, всё так просто. Спасибо.
>тиосульфата натрия с хлорной водой
С сильными окислителями, например, свободным хлором, окисляется до сульфатов или серной кислоты:
Na2S2O3 + 4Cl2 + 5H2O → 2H2SO4 + 2NaCl + 6HCl
Na2S2O3 + Cl2 + H2O = Na2SO4 + H2SO4 + HCl
1) Всегда у активированной частицы С достаточно энергии для протекания обратной реакции распада на А и Б?
2) Если энергии достаточно, то каким образом частица может избежать этого распада в условиях, когда она одна в вакууме?
Просто столкнулся с утверждением коллеги, что в такой ситуации частица С должна неминуемо распасться на А и Б и С не сможет образоваться никак.
>Если энергии достаточно, то каким образом частица может избежать этого распада в условиях, когда она одна в вакууме?
Никак не может. Только если не сбросит тепловой фотон куда-нибудь.(Я не уверен, что такой переход разрешен). Но в теории активированного комплекса, обычно пишут распад обратно.
Я имел в виду, что если эта частица С будет двухцентровая, то есть будет связь А---Б, то если она будет быстро вращаться, но слабо колебаться по этой связи, то она не распадётся? Или это уже вообще не возбуждённое состояние?
Можно конечно подумать об этом, думаю какой-нибудь физик старшекур, может расшарить и всё расписать. Но энергии то у неё достаточно чтобы развалиться в любом случае.
бампаю
открыл какой-то старый технический кчебник по коллоидной и физической химии и увидел куча страшных формул
>а могут ли быть нуклоны из трех одинаковых кварков
>из трех d-кварков
Нет, потому что они заряжены.
d-кварк имеет заряд +2/3.
+2/3 × 3 = +6/3 = 2e, это частица с двойным зарядом. Таких не бывает.
>или трех u-кварков
А вот это больше похоже на реальность.
Заряд u-кварка −1/3. −1/3 × 3 = −3/3 = −1. Смахивает на антипротон, но это не антипротон.
У антипротона - антикварки внутри. А кварковый состав протона - uud.
−1/3 + +2/3 + +2/3 = 3/3,
соответственно у антипротона - кварковый состав анти-u анти-u анти-d,
и заряды обратные:
1/3 + (−2/3) + (−2/3) = −3/3 = −1;
А вообще - гугли пентакварк.
2. Почему керосин редко используется в двигателях внутреннего сгорания? Причина только в цене керосина?
3. Что будет, если в подобный двигатель залить обычный бензин?
>открыл учебник
>увидел формулы
А что ты вообще ожидал увидеть? Любое объяснение предполагает формулы.
>Основа бензина - это бензол?
Нет. Бензол - кольцо ароматическое, его извлекли из бензина, потому так и назвали. Наоборот эту срань канцерогенную всячески пытаются из бензина изжить.
>В Википедии не описан состав бензина. Гугель не помог.
Бензин - смесь углеводородов, длинна цепочек которых достаточна, чтобы не кипеть при комнатной температуре. Вообще различают природный газ - метан, нефтяные газы - этан, пропан, бутан, и их непредельные братья этилен, пропилен, бутилен, ацетилен, пропин, бутин, бензиновые углеводороды - пентан, гексан, гептан и октан и их братья - изопентан, и т.п. Далее идут дизельные углеводороды - нонан, декан, додекан и т.п., после дизельных - керосиновые, после них масельные, потом мазутные и потом битумные (или "парафины" одним словом).
Все они отличаются длиной и температурой кипения, хотя часто менее длинные углеводороды образуя изомеры или имея двойные-тройные связи кипят при более высоких температурах и потому их пихают в топливо с более длинными цепочками.
Ввиду принципов работы ДВС различают бензин и дизтопливо. Основное требование к бензинам - это не детонировать (т.е. гореть со сверхзвуковой скоростью), при сжатии воздушно-бензиновой смеси. Для этого используют разные присадки, например спирты. Степень сжатия определяется в октановых числах, т.е. в процентах смеси изооктана к н-гептану, которая детонирует при определённом давлении. Чем выше степень сжатия, тем выше КПД двигателя.
В дизеле же сжимается воздух, а топливо впрыскивается в цилиндр, потому степень сжатия дизелей выше чем у бензинов, при этом дизтопливо обычно содержит более длинные цепочки.
В России ещё различают летнее и зимнее дизтопливо, которое отличается содержанием парафинов. Летнее топливо зимой засирает парафинами фильтры.
>Почему керосин редко используется в двигателях внутреннего сгорания? Причина только в цене керосина?
Керосины - ещё более длинные углеводороды. Они используются в авиации по одной простой причине, чем длиннее цепочка, тем больше молекула содержит углерода и тем выше соотношение углерода к водороду в топливе. Чем выше это соотношение, тем больше весит один кубический сантиметр топлива и тем больше энергии содержит один грамм топлива.
Таким образом, куда выгоднее использовать в самолётах керосин, потому что он более эргичный, занимает меньше места на грамм и его можно жечь в турбинах не опасаясь за детонацию.
>Основа бензина - это бензол?
Нет. Бензол - кольцо ароматическое, его извлекли из бензина, потому так и назвали. Наоборот эту срань канцерогенную всячески пытаются из бензина изжить.
>В Википедии не описан состав бензина. Гугель не помог.
Бензин - смесь углеводородов, длинна цепочек которых достаточна, чтобы не кипеть при комнатной температуре. Вообще различают природный газ - метан, нефтяные газы - этан, пропан, бутан, и их непредельные братья этилен, пропилен, бутилен, ацетилен, пропин, бутин, бензиновые углеводороды - пентан, гексан, гептан и октан и их братья - изопентан, и т.п. Далее идут дизельные углеводороды - нонан, декан, додекан и т.п., после дизельных - керосиновые, после них масельные, потом мазутные и потом битумные (или "парафины" одним словом).
Все они отличаются длиной и температурой кипения, хотя часто менее длинные углеводороды образуя изомеры или имея двойные-тройные связи кипят при более высоких температурах и потому их пихают в топливо с более длинными цепочками.
Ввиду принципов работы ДВС различают бензин и дизтопливо. Основное требование к бензинам - это не детонировать (т.е. гореть со сверхзвуковой скоростью), при сжатии воздушно-бензиновой смеси. Для этого используют разные присадки, например спирты. Степень сжатия определяется в октановых числах, т.е. в процентах смеси изооктана к н-гептану, которая детонирует при определённом давлении. Чем выше степень сжатия, тем выше КПД двигателя.
В дизеле же сжимается воздух, а топливо впрыскивается в цилиндр, потому степень сжатия дизелей выше чем у бензинов, при этом дизтопливо обычно содержит более длинные цепочки.
В России ещё различают летнее и зимнее дизтопливо, которое отличается содержанием парафинов. Летнее топливо зимой засирает парафинами фильтры.
>Почему керосин редко используется в двигателях внутреннего сгорания? Причина только в цене керосина?
Керосины - ещё более длинные углеводороды. Они используются в авиации по одной простой причине, чем длиннее цепочка, тем больше молекула содержит углерода и тем выше соотношение углерода к водороду в топливе. Чем выше это соотношение, тем больше весит один кубический сантиметр топлива и тем больше энергии содержит один грамм топлива.
Таким образом, куда выгоднее использовать в самолётах керосин, потому что он более эргичный, занимает меньше места на грамм и его можно жечь в турбинах не опасаясь за детонацию.
>Степень сжатия определяется в октановых числах, т.е. в процентах смеси изооктана к н-гептану, которая детонирует при определённом давлении.
Ну т.е. сравнивают пробу бензина и такую смесь.
Да, могут, например Δ++ барион состоит из uuu - кварков, а его брат Δ− состоит из трёх ddd кварков.
Ω++ барион вообще состоит из трёх странных антикварков sss. Другое дело, что наблюдался пока только Ω- барион из трёх обычных странных кварков sss.
 99 Кб, 778x667
99 Кб, 778x667Почему при обратном осмосе множитель обессоливания раствора увеличивается с каждой проведения очистки?
То есть допустим был 1% солей в растворе.
После первой очистки их стало 0,5% например, то есть множитель очистки 2
После второй очистки их стало 0,2%, то есть множитель стал 2,5
После третьей очистки их стало 0,5 то есть множитель очистки стал 4
Это грубый пример, на самом деле множитель меняется скромнее, но меняется. Я предположил, что чем более обессоленее раствор, тем меньше движущая сила самого осмоса, а значит менее препятствует созданным давлением обратному осмосу.
Возможно я прав, но сейчас почти ночь а я очень устал головой, и я боюсь что я ошибаюсь, а мне нужно будет как-то объяснить причину увеличения обессоливания.
бамп
Ну вот это да. Такой вот бекграунд нужен любому учебнику, поэтому всем дают мат. базу
3 пикча годная
Википедия говорит, что 150
https://ru.wikipedia.org/wiki/Пероксид_водорода
А вот этот сайт, что 67
https://melscience.com/ru/articles/reakciya-razlozheniya-perekisi-vodoroda-i-ee-osobe/
Кто пиздит, кто прав? Или я что-то не понимаю. Алсо, какая температура разложения перекиси?
>Но ведь основа у всех бензинов одинаковая, хотелось бы её узнать .
Нет там просто смесь углеводородов
Неполярные - это обычно масла и другие углеводороды, например, бензин, гексан, у которых нет свисающего кислорода на конце.
The boiling point of H2O2 has been extrapolated as being 150.2 °C, approximately 50 °C higher than water. In practice, hydrogen peroxide will undergo potentially explosive thermal decomposition if heated to this temperature. It may be safely distilled at lower temperatures under reduced pressure.
В полярных растворителях дипольный момент (т.е. степень разделения зарядов в молекуле) выше. Из неполярных наиболее доступен и безвреден диэтиловый эфир
>Исключительно для общего развития.
Тогда неполенись и найди курс видеолекции на ютубе если уж совсем не можешь читать учебники. А если ты серьезно хочешь в химию то придется читать, читать много, думоть, спрашивать и еще думоть.
>>41538
Это жи теория, в химии сначала делается практика, а по ней уже пишется теория. Ты не уточняешь почему конкретно написана практика.
1. Называть летучее моторное топливо словом "бензин" придумал конченный мудак. В интернете есть состав бензина, там сотни веществ.
2. Керосином называют продукт грубой обработки нефти. Современные ДВС намного более требовательным к топливу, чем 100 лет назад.
>3. Что будет, если в подобный двигатель залить обычный бензин?
В какой "подобный"? Модель и производителя назови.
>>41533
>Бензол - кольцо ароматическое, его извлекли из бензина, потому так и назвали.
Нет.
>Наоборот эту срань канцерогенную всячески пытаются из бензина изжить.
Нет.
>бензиновые углеводороды - пентан, гексан, гептан и октан и их братья - изопентан, и т.п. Далее идут дизельные углеводороды - нонан, декан, додекан и т.п., после дизельных - керосиновые, после них масельные, потом мазутные и потом битумные (или "парафины" одним словом).
Нет:
https://ru.wikipedia.org/wiki/Фракционный_состав_нефти
до 100 °С — петролейная фракция;
до 140 °С — бензиновая фракция;
140–180 °С — лигроиновая фракция;
180–220 °С — керосиновая фракция;
220–350 °С — дизельная фракция.
>>41590
>Поясните за полярные/неполярные растворители?
https://ru.wikipedia.org/wiki/Полярные_вещества
"Полярные вещества в химии — соединения, молекулы которых обладают электрическим дипольным моментом."
>>41694
>Из неполярных наиболее доступен и безвреден диэтиловый эфир
Дипольный момент диэтилового эфира 1.28 D - это среднеполярное вещество, примерно на том же уровне, что и хлороформ, спирты, вода.
https://pubs.acs.org/doi/abs/10.1021/ja01166a527
1. Называть летучее моторное топливо словом "бензин" придумал конченный мудак. В интернете есть состав бензина, там сотни веществ.
2. Керосином называют продукт грубой обработки нефти. Современные ДВС намного более требовательным к топливу, чем 100 лет назад.
>3. Что будет, если в подобный двигатель залить обычный бензин?
В какой "подобный"? Модель и производителя назови.
>>41533
>Бензол - кольцо ароматическое, его извлекли из бензина, потому так и назвали.
Нет.
>Наоборот эту срань канцерогенную всячески пытаются из бензина изжить.
Нет.
>бензиновые углеводороды - пентан, гексан, гептан и октан и их братья - изопентан, и т.п. Далее идут дизельные углеводороды - нонан, декан, додекан и т.п., после дизельных - керосиновые, после них масельные, потом мазутные и потом битумные (или "парафины" одним словом).
Нет:
https://ru.wikipedia.org/wiki/Фракционный_состав_нефти
до 100 °С — петролейная фракция;
до 140 °С — бензиновая фракция;
140–180 °С — лигроиновая фракция;
180–220 °С — керосиновая фракция;
220–350 °С — дизельная фракция.
>>41590
>Поясните за полярные/неполярные растворители?
https://ru.wikipedia.org/wiki/Полярные_вещества
"Полярные вещества в химии — соединения, молекулы которых обладают электрическим дипольным моментом."
>>41694
>Из неполярных наиболее доступен и безвреден диэтиловый эфир
Дипольный момент диэтилового эфира 1.28 D - это среднеполярное вещество, примерно на том же уровне, что и хлороформ, спирты, вода.
https://pubs.acs.org/doi/abs/10.1021/ja01166a527
>Дипольный момент диэтилового эфира 1.28 D - это среднеполярное вещество, примерно на том же уровне, что и хлороформ, спирты, вода.
Диэлектрические константы посмотри, все что ниже 5 - неполярный растворители. Среднеполярные апротонные - это ТГФ и ДХМ, например.
>Диэлектрические константы посмотри, все что ниже 5 - неполярный растворители.
А давай все подряд называть критерием полярности? Например, константу кислотой диссоциации - замечательный критерий. Вода, диметилформамид, ацетон как раз оказываются полярными.
Кстати, примечательно, что ты произвольно взял цифру диэлектрической константы 5, хотя обычно берут 10 и уксусная кислота отправляется в категорию неполярных, несмотря на диполь 2.85 D. Правда, дихлорэтан оказывается полярным в любых раскладах с его 10.4, рядом с дихлорбензолом 10.0, дихлорметаном 8.9, и трифторуксусной 8.5. Этил бензоат, кстати - полярное вещество, диэлектрическая константа 6.0, что близко к этилацетату 6.0, уксусной кислоте 6.1, и тетрагидрофурану 7.6.
>обычно берут 10
Кто берет, епт? В твоей пещере не выделяют промежуточный класс растворителей с константой 5-10? Если ты ещё не заметил, мы о растворителях говорим, а не просто о полярных/неполярных веществах. Эфир у него "примерно на том же уровне, что и вода". Давай, замени экстракцию эфиром на экстракцию водой, они же на одном уровне. Или спирт в элюенте замени на воду.
>В твоей пещере не выделяют промежуточный класс растворителей с константой 5-10?
Промежуточный класс, вроде уксусной-муравьиной кислоты? Охуительная история.
Куда предлагаешь отнести гексаметилфосфорамид, который у всех культурных людей считается сверхполярным, а в твоей классификации занимает место у параши рядом с метанолом и нитробензолом?
Теория про диэлектрическую проницаемость как характеристику растворимости придумали, когда поняли, что обосрались с попыткой применить полярность для предсказания растворимости. Но вместо этого, как обычно, просто обосрались второй раз, поскольку и полярность, и диэлектрическая проницаемость сами по себе слабо кореллируют с растворимостью: можно найти вещества с высокой полярностью и диэлектрической проницаемостью, которые нерастворимы в воде (нитробензол), и при этом найти вещества с низкой диэлектрической проницаемостью, которые смешиваются с водой в любых пропорциях (уксусная кислота).
>Давай, замени экстракцию эфиром на экстракцию водой, они же на одном уровне. Или спирт в элюенте замени на воду.
Я писал только то, что я писал. Я не предлагал заменять в экстракции эфир на воду, я лишь написал, чт ополярность дихлорметана, спирта, воды, и эфиров примерно одинакова.
К слову, на википедии до недавних пор был указан неправильный дипольный момент дихлорметана, потому что у специалистов по полярности рвало шаблоны от большой полярности дихлорметана на фоне низкой растворимости в воде.
Ах да, есть еще такое замечательное вещество, которое смешивается с водой - диэтиламин: диэлектрическая проницаемость 3.6, дипольный момент 0.92 D.
>Нахуй вы спорите о семантике? Это же бессмысленно.
Ежик гитлер самантический столб. Химии акбар.
>Это я не говорю о том, что вы протонные и апротонные под одной гребенкой пытаетесь рассмотреть.
А как насчет диэтиламина? Апротонный и неполярный. Это мы даже до макроструктур еще не добрались, вроде амидов, целлюлозы, силикагеля. Напомню классический метод экстракции нормальных парафинов при помощи мочевины.
>Нет
Да. Разделение по температуре монопенисуально разделению по длине углеводородной цепи, но понятнее.
Где у тябе там протон? Это же протонна губка, у ней протон могёт быть токмо ежели ты ево туда запхнешь ногой. А так-то ты волен и на этан повесить протон али отнять его - ты этан соизволишь назвать протонным теперяче?
>>41818
>Разделение по температуре монопенисуально разделению по длине углеводородной цепи, но понятнее.
Щас бы узнать, что у парафинов молекулярный вес и температура кипения не взаимосвязаны.
>Напомню классический метод экстракции нормальных парафинов при помощи мочевины.
Сайентач образовательный. Век живи, век учись. Есть что-нибудь древнее и интересное почитать по теме?
Бери всегда на уровень выше
Короч, загорелся я тут идеей пиво сварить. Ну, вообще давно этой идеей загорелся - еще два года назад, но тогда решил что слишком сложно и от этой мысли отказался. А сча опять вспомнил, досконально изучил весь процесс ну и таки буду варить.
Короч, изготовление пива делается в несколько этапов:
1. Делается солод. Солод - пророщенный ячмень. В пророщенном ячмене образовываются нужные нам ферменты (фитаза, бета-глюканаза, пептидаза, протеиназа, альфа-амилаза, бета-амилаза).
2. Дальше варится сусло (пивовары называют это "затиранием солода"). Берется солод, берется крахмало-содержащее сырье (не пророщенная пшеница, кукуруза или собсно сам солод). Заливается водой и варится.
3. Дальше, когда сусло сварено - фильтруется, еще раз варится с хмелем, заливается в бродильную емкость и сбраживается дрожжами.
При варке сусла делаются "температурные паузы". Сусло нагревается до нужной температуры и при этой температуре выдерживается некоторое время. Каждый из ферментов проявляет наибольшую активность в определенном температурном диапазоне.
Кислотная пауза. Фитаза и глюканаза работает в температурном диапазоне 35-45°. Под действием этих ферментов понижается PH сусла.
Белковая пауза. Пептидаза и протеиназа (около 50° и 55° соответственно) хавоют белок, который делает пивасик мутным.
Осахаривание. Самая главная пауза. Делаются две паузы:
Около 62° - бета-амилаза откусывает от крахмала мальтозу. Мальтозой при сбраживании питаются дрожжи. Если не сделать эту паузу - останется крахмал, который дрожжи не хавоют и пиво не забродит, а заплесневеет.
Около 72° - альфа-амилаза разрывает крахмал в рандомных местах и на выходе получается декстрин. Декстрин дрожжи не хавоют, но он дает вкус и аромат пиву.
Короч, незамысловатый процесс. Кислотную (да и зачастую белковую) паузу все игнорируют. Заливают в кастрюлю воду, пшеницу и ячменный солод. Греют до 62°. Укутывают кастрюлю в батину куртку, дают постоять полчаса. Потом греют до 72°, опять укутывают и дают постоять еще полчаса. Остается только отфильтровать, сварить с хмелем и залить в бродильную емкость.
Я таки думал по всем паузам пробежаться. Все таки первый раз варить собрался - надо основательно делать, а не на отъебись. Кроме осахаривания сделать еще две белковые паузы по полчаса.
Но самый кек в другом. Короч, я еще тогда, два года назад, думал что пшеничное или ржаное пиво - это слишком банально и надо делать из экзотического сырья. Тогда думал из картошки делать. Тут вот повторно пивоварением загорелся и опять думаю, картошка-картошка... а на днях в голове мыслишка пробежала, озарение можно сказать - ФАСОЛЬ. Всё, бля, навязчивая идея. Спать не могу - хочу фасолевое пиво сварить. Начал гуглить за фасоль. 60% крахмала - охуенчик. 30% белка - не охуенчик, но можно подольше белковые паузы выдержать, стало быть тоже не проблема. А тут вот сегодня нагуглил, что фасоль содержит какую-то бяку, Фазеоламин некий, который ингибирует альфа-амилазу. Что ну очень паскудно. В каких условиях этот фазеоламин диссоциирует - нагуглить практически невозможно - одни сплошные рекламы таблеток для похудения в выдаче. Нашел в забугорном Интернете статью (3-й пикрелейтед). На 4-ом пикрелейтеде графики. Я англицкий немношк шарю, но тут специфическая терминология и тяжко.
Поясните, что на этих графиках изображено?
Можно ли как-то этот фазеоламин кекнуть из фасоли, тупо взяв ее и прокипятив часа эдак три, перед внесением солода?
Короч, загорелся я тут идеей пиво сварить. Ну, вообще давно этой идеей загорелся - еще два года назад, но тогда решил что слишком сложно и от этой мысли отказался. А сча опять вспомнил, досконально изучил весь процесс ну и таки буду варить.
Короч, изготовление пива делается в несколько этапов:
1. Делается солод. Солод - пророщенный ячмень. В пророщенном ячмене образовываются нужные нам ферменты (фитаза, бета-глюканаза, пептидаза, протеиназа, альфа-амилаза, бета-амилаза).
2. Дальше варится сусло (пивовары называют это "затиранием солода"). Берется солод, берется крахмало-содержащее сырье (не пророщенная пшеница, кукуруза или собсно сам солод). Заливается водой и варится.
3. Дальше, когда сусло сварено - фильтруется, еще раз варится с хмелем, заливается в бродильную емкость и сбраживается дрожжами.
При варке сусла делаются "температурные паузы". Сусло нагревается до нужной температуры и при этой температуре выдерживается некоторое время. Каждый из ферментов проявляет наибольшую активность в определенном температурном диапазоне.
Кислотная пауза. Фитаза и глюканаза работает в температурном диапазоне 35-45°. Под действием этих ферментов понижается PH сусла.
Белковая пауза. Пептидаза и протеиназа (около 50° и 55° соответственно) хавоют белок, который делает пивасик мутным.
Осахаривание. Самая главная пауза. Делаются две паузы:
Около 62° - бета-амилаза откусывает от крахмала мальтозу. Мальтозой при сбраживании питаются дрожжи. Если не сделать эту паузу - останется крахмал, который дрожжи не хавоют и пиво не забродит, а заплесневеет.
Около 72° - альфа-амилаза разрывает крахмал в рандомных местах и на выходе получается декстрин. Декстрин дрожжи не хавоют, но он дает вкус и аромат пиву.
Короч, незамысловатый процесс. Кислотную (да и зачастую белковую) паузу все игнорируют. Заливают в кастрюлю воду, пшеницу и ячменный солод. Греют до 62°. Укутывают кастрюлю в батину куртку, дают постоять полчаса. Потом греют до 72°, опять укутывают и дают постоять еще полчаса. Остается только отфильтровать, сварить с хмелем и залить в бродильную емкость.
Я таки думал по всем паузам пробежаться. Все таки первый раз варить собрался - надо основательно делать, а не на отъебись. Кроме осахаривания сделать еще две белковые паузы по полчаса.
Но самый кек в другом. Короч, я еще тогда, два года назад, думал что пшеничное или ржаное пиво - это слишком банально и надо делать из экзотического сырья. Тогда думал из картошки делать. Тут вот повторно пивоварением загорелся и опять думаю, картошка-картошка... а на днях в голове мыслишка пробежала, озарение можно сказать - ФАСОЛЬ. Всё, бля, навязчивая идея. Спать не могу - хочу фасолевое пиво сварить. Начал гуглить за фасоль. 60% крахмала - охуенчик. 30% белка - не охуенчик, но можно подольше белковые паузы выдержать, стало быть тоже не проблема. А тут вот сегодня нагуглил, что фасоль содержит какую-то бяку, Фазеоламин некий, который ингибирует альфа-амилазу. Что ну очень паскудно. В каких условиях этот фазеоламин диссоциирует - нагуглить практически невозможно - одни сплошные рекламы таблеток для похудения в выдаче. Нашел в забугорном Интернете статью (3-й пикрелейтед). На 4-ом пикрелейтеде графики. Я англицкий немношк шарю, но тут специфическая терминология и тяжко.
Поясните, что на этих графиках изображено?
Можно ли как-то этот фазеоламин кекнуть из фасоли, тупо взяв ее и прокипятив часа эдак три, перед внесением солода?
ХЗ, как там с активностью пептидазы и протеиназы, но гипотетически они должны быть в состоянии переварить этот самый фазеоламин, который, насколько я понял, белковой природы. Если не будет осахариваться, увеличивай длительность белковой паузы. Если совсем хуёво будет работать, то вари потом пару часов в скороварке.
А чисто температурой его убить нельзя, чтобы он свернулся там, денатурировался или диссоциировался? Рассматриваю даже вариант прогреть предварительно фасоль в духовке.
Если варить потом пару часов в скороварке - амилазы кекнут. Есть еще одна температурная пауза, которую делают пивовары - "мэш-аут" при 78°. Делают ее, чтобы все ферменты кекнули (денатурировали). То есть, варить надо до внесения ферментов (солода).
Второй момент - амилазы тоже белковой природы. Боюсь, как бы их белковой паузой не кекнуть.
Исходное исследование датируется 1955 годом, в нем изучали взаимодействие молока с мочевиной:
M. F. Bengen: Mein Weg zu den neuen Harnstoff-Einschluß-Verbindungen. In: Angewandte Chemie. 63, 1951, p. 207, doi:10.1002/ange.19510630903.
>>41857
>Что для тебя важнее, кислый протон или возможность водородных связей?
Для меня важнее то, что мой собеседник прочитал книгу и получил иллюзию понимания механизмов растворимости, хотя этого понимания у него на самом деле нет. Диэталамин - это апротонное неполярное вещество. Точка. У него может быть какая-то там растворимость и чем-то она вызвана, но оно неполярно, апротонно, и у него низкая диэлектрическая проницаемость.
Химия, как наука, руководствуется объективными критериями, которые можно проверить, измерить. Хуету, которую вы подразумеваете под полярностью, нельзя проверить и измерить, главным образом потому, что вы сами не знаете, что под ней подразумеваете.
>Исходное исследование датируется 1955 годом, в нем изучали взаимодействие молока с мочевиной
Спасибо, охуенная история.
Нахуй ты сливаешься, такими дешевыми вещами?
>мой собеседник прочитал книгу и получил иллюзию понимания
Так делают только кретины, у которых их собственная логика потекла, и они свои штаны начинают спасать. Любой кто пытается привязываться к четким определениям, особенно настолько дурацким как "протонный-апротонный" "полярный-неполярный" закономерно обсирается, так как химия это не про "мам, такая циферка вот, поэтому не должно растворяться, как не растворяется? Но оно же неполярное, оно же апротонное...я в книжке прочитал". Надо иметь нихуевую интуицию химическую, которую, либо руками можно заработать, либо уметь орбитали чувствовать, скажем так, пальцами одной руки, и энтальпии веществ до порядка предсказывать. Но нет, сидят дебилы о семантике рассуждают. Ты хоть как назови диэтиламин, он свои свойства не поменяет.
>интуицию химическую
Окей. Не только лишь все могут смотреть в завтрашний день. Пойду к цыганам - пусть мне растворимость предскажут.
И мы с тем аноном подождем кого-нибудь старше 10 лет.
А как у неё с реакционной способностью? Это, в принципе, первое, о чем я подумал, хз будет ли работать. Но я пока не собираюсь на нем экстрагировать ничего кроме обычных травок и веществ оттуда.
Самое обидное, что он новый и я его еще поюзать не успел - отломил, когда мыл его.
Тогда не покатит. В воде не растворяется, а вот в горячем спирте - растворяется.
>веществ
ВЕЩЕСТВ?
Я получал щавелевую кислоту окисляя сахар гор. азоткой, концентрация коей 56.2%, нагревал на плитке, все вроде шло по плану, NO2 вылетал из стакана как йобнутый, но я короче занеся домой стал проверять хлоридом кальция (странно было то, что осадок появлялся не сразу, нужно было ждать) и сульфатом железа (осадка вообще не было). Ну и я забил на это, думая, что все в порядке, оставил ее (кислоту) в стакане. Ну и месяц спустя я наблюдал там только сироп и запах NO2. Теперь вопросы
1)где я накосячил в изготовлении щавелевой?
2)стоило ли это проводить на морозе или нужно было в тепле?
3)почему выпадал осадок в реакции с CaCl2 и почему не было реакции с FeSO4?
Ну некоторые и с кофеина в чае отъезжают, так что пусть будут ВЕЩЕСТВА.
А так да, разная хренота с травок и прочей ерунды. Скорее всего, я просто забью хер, и замотаю какой-нибудь изолентой, благо оно там не сильно греется, и не травит по дефолту. Будет совсем мешать, куплю новый, что поделать, если я рукожоп.
У тебя соотношение сахара с кислотой какое было? А то там наокислять до чего угодно можно. И кислоту я бы разбавил раза в полтора.
>Брагу сначала научись делать мой тебе совет.
Кек чебурек? Как-то, лет 10 назад, мне пакет дрожжей в руки нагуглился. Куда я этой хуйни только не сыпал. Вся комната трехлитровыми банками и полторашками была заставлена. Классическая сахарная брага, брага из мандаринов... Мамка ягод каких купит - вся семья похавает, а я свою порцию в банку и дрожжей сверху. Блеть, я чай заваривал сладкий и туда даже дрожжи хуярил.
Кстати, раствор подкисленного серной к-той KMnO4 обесцвечивался при добавлении полученного мной в ходе реакции р-ра
>я этой хуйни только не сыпал.
Вот ты не понимаешь даже разницы между насыпать сухих дрожжей и вывести культуру. Какое тебе пиво? Иди порошочное пей, быдлан.
Разбавить надо кислоту раза в полтора-два. Со слишком концентрированной получается бурда. Мезоксалевая кислота там может вылезти. Впрочем, без катализатора выход у этой реакции и так небольшой: процентов двадцать - двадцать пять. Подкисленный перманганат такая штука, что окисляет все подряд, и обесцвечивание его раствора - не показатель.
Надо убирать нагрев сразу после начала реакции. Кристаллы кислоты выпадали? Почему не отфильтровал и не перекристаллизовал в тот же день?
Как проще получить свободное основание (можно водное)?
Затем, что могу.
Получилось, в принципе, экстрагировать изопропанолом из сухой смеси гуанидиния нитрата и гидроксида натрия, которая несколько часов колбасилась сильной механической мешалкой, но способ так себе, заёбисто и выход низкий.
ОК, может пойдёт, но я почти не имею с нй опыта работы. Как бы ты конкретно предложил сделать?
Нужен сильноосновный анионит? Напомню, что гуанидин - сильное основание, не хуже NaOH.
так вот для натрия какие будут условия ниже выше температура ? ибо меньше минус 20 поддерживать не так
просто
и также интересно почему в ру вики про отриц темп ничего не упоминается
В твердом растворе всегда 1 фаза, а в сплаве фаз может быть несколько. Кроме того, преобладающие компоненты сплава - это металлы.
А какой катализатор можно взять?
Читал что фосфаты для удобрений сейчас в смесях в основном.
Кто-нибудь может пояснить за высаливание растворов? Хотет попробовать, поташа нет, использовал просто поваренную соль для отделения спирта от воды. На две фракции не разделяется. Я тупой?
Реакции расписать не судьба, или то что видел не совпало с тем что должно было быть теоретически?
 497 Кб, webm,
497 Кб, webm,1280x720, 0:03
Ходит кулстори про то как пара химиков спарятала от фашистов во время второй мировой золото растворив его в царской водке, а потом восстановив обратно.
Видимо, мне за таким смекалистыми химиками в научпоп и статьи в википедии
Свинец чистый? Вряд ли.
>золото
Не золото, а медаль от Нобелевской премии, после чего из восстановленного золота отлили медаль заново.
>Эта webm-ка...
Видеорелейтед: https://www.youtube.com/watch?v=Zdw1PFjVwXU
>Ходит кулстори про то как пара химиков спарятала от фашистов во время
>второй мировой золото растворив его в царской водке, а потом восстановив обратно.
>>42568
>Не золото, а медаль от Нобелевской премии, после чего из восстановленного золота отлили медаль заново.
Там, короче, тетрахлороаурат водорода образуется.
При нагревании - он разлагается так:
(156 — 205 °C) H[AuCl4] → AuCl + HCl + Cl2
А вот чтобы получить металлическое золото из монохлорида золота,
нужно проделать следующую реакцию:
3AuCl + 4KBr -> K[AuBr4] + 2Au + 3KCl
или же с хлористым калием:
3AuCl + КCl = 2Au + К[AuCl4]
Тетрахлороаурат и тетрабромоаурат калия - также разлагаются с выделением металлического золота,
но при нагревании. Например: 2K[AuCl4]⋅2H2O -> 2Au + 2KCl + 3Cl2↑ + 4H2O↑
>>42589
>Эта webm-ка...
>Видеорелейтед: https://www.youtube.com/watch?v=Zdw1PFjVwXU
https://www.youtube.com/watch?v=WzhW20hLp6M
>Именно! Поэтому всё в открытом доступе.
А есть ли у химиков какие-то секретные материалы с грифом ДСП (или даже Секретно/Совершенно секретно)?
Инб4: синтез Новичка.
Он внутри Юпитера есть, там давление большое надо.
Ты хоть знаешь при каком давлении его получили на Земле?
На, читни это: https://life.ru/t/наука/965429/rievoliutsionnyi_mietallichieskii_vodorod_vpiervyie_poluchili_pri_nizkoi_tiempieraturie
>После модификации ячейку с алмазной наковальней использовали для получения металлического водорода
>при температуре 5,5 кельвина и давлении в 495 гигапаскалей. Это почти в пять миллионов раз выше атмосферного.
>5,5 кельвина — рекордно низкая температура для такого давления.
>А есть ли другие примеры двух фазовых состояний одного вещества,
>которые обе являются стабильными при нормальных условиях,
>при этом энергия перехода из одного состояния в другое очень велика?
Я принёс тебе немного гексафторида ксенона из своего поста в треде про колонизацию Титана: >>433159
>Ты хоть знаешь при каком давлении его получили на Земле?
Ну где-то вродь говорилось, что после снятия давления он останется таким же.
Да ну, он даже не подвержен сублимации? Только под лазером каким-то, да?
Да его бы уже в консервных банках по базарам возили, и баки бы им заправляли.
Химия благовоний и техника пользования кадилом.
>Да его бы уже в консервных банках по базарам возили
Его только в мизерных количествах получали.
Вопрос, что бухнул алкан что у него отвалились почки за сутки? Тормозуха?
Тогда уж испанского
А если бы с самого начала начали делать то, что стали делать апосля, на всякий случай, так сказать, тоже бы сдох?
 23 Кб, 500x350
23 Кб, 500x350На, прогрузи, и посмотри отсюда: https://youtu.be/hdHMNr9GDfQ?t=6m47s
Там дальше про орбитали инфа, и этот твой бублик dz2 на 13:20
 109 Кб, 1056x469
109 Кб, 1056x469Вот квантовые числа n, l и m для различых конфигураций электронных облаков.
Как видишь
>dz2
имеет набор квантовых чисел n=3, l=2, m = 0;
>состояние электрона в атоме и вид описывающей его волновой функции
>могут быть охарактеризованы четырьмя квантовыми числами:
>главным n, орбитальным l, магнитным m и спиновым m.
Спиновое квантовое число на форму орбиталей не влияет, но влияет на количество электронов на одной орбитали и энергии у них, а также указывает на то, какие электроны как спарены на одной орбитали,
потому что там принцип запрета Паули и правило Хунда.
Как писал анон ниже, да, это одно из решений для атома водорода, с квантовыми числами 3 2 0.
>только один электрон может по кругу бегать
Смотри какое дело, электрон не бегает, так как понятие траектории в квантовой механике отсутствует. Это скорее форма волны плотности вероятности, которая вокруг ядра есть. Но кое-что о "движении" электрона на этой орбитали мы можем сказать. Квантовые числа l=2 и m = 0 говорят нам, что у этого электрона есть момент импульса равный 2, а проекция оси момента на ось z равна 0.
Разве не орбиталь это плотность вероятности? А сам электрон это вполне себе частица даже вроде как с размерами (не более 10^-20 - вики).
10^-20 см
Плотность вероятности, сугубо положительная величина, как ты понимаешь. На цветной картинке изображена волновая функция, так как имеет разный знак.
>А сам электрон это вполне себе частица даже вроде как с размерами
Это довольно тонкий разговор про размеры. Всё же, ты не можешь пользоваться понятием траектории, так как та, предполагает знание импульса и положения в каждой точке траектории, а у нас фундаментальные запреты на знание этих двух вещей сразу. Так еще и например, сразу после точного измерения положения частицы, в следующий момент времени, она может быть где угодно.
Бамп вопросу.
>(поглотитель кислорода) на основе железных опилок(или порошка) и поваренной соли
А разве железо не медленно ржавеет.
Я бы герметичный холодильник - свечку поставил,
чтоб кислород выгорел, и она потухла.
Свечка давала бы CO2, но она каптила бы.
Поэтому, как вариант - периодически включающийся, быстро разогревающийся и затем полностью остывающий,
раскаляющийся пирографитовый электрод под током, выжигающий кислород в CO2.
Включать импульсно, с интервалами, чтобы не перегреть холодильник и продукты.
МАСПице каждый раз будешь вакуумным упаковщиком после завтрака запаковывать? А пакет с картошкой?
Тащемта пачка масла успевает заветриться, если ее есть в одиночку понемногу, даже если лежит в герметичной масленке.
Дарю лайфхак: масло можно хранить в морозилке, и доставать небольшие куски по мере надобности. Хлеб тоже отлично хранится в морозилке.
> Хлеб тоже отлично хранится в морозилке.
Только он портится там быстрее чем на столе в хлебнице. Поэтому никто не хранит его там.
 272 Кб, 576x768
272 Кб, 576x768>Дарю лайфхак: масло можно хранить в морозилке, и доставать небольшие куски по мере надобности.
>>42951
>> Хлеб тоже отлично хранится в морозилке.
>Только он портится там быстрее чем на столе в хлебнице.
Вот чтобы еботнёй с замерзшим маслом и отсыревшим хлебом из морозилки не заниматься, можно один раз сделать поглотитель кислорода, но нужно знать скорость поглощения им кислорода. Доктора наук сидят, а ничего кроме "лайфхаков" предложить не могут.
Чем шире место, в котором у тебя метка, тем больше погрешность.
>Нужен сильноосновный анионит? Напомню, что гуанидин - сильное основание, не хуже NaOH.
Помню, кто-то мне говорил много лет назад "в интернете поищи, там все есть". Вот я сейчас погуглил, и выяснил, что мудаков в интернетах намного больше, чем адекватных поцыков. Что естественно, ведь кому нечего сказать, тот кричит громче всех - нужно же как-то компенсировать.
Незамещенный гуанидин в воде имеет pkb~1.5 [1], и это не такое уж и сильное основание. Чтобы получить действительно сильное основание, нужно либо полность, замещать гуанидин аля DBU, либо использовать протонные губки [2] .
Четвертичные аммонийные соединения в метилизубутил кетоне имеют константу диссоциации с сильными кислотными анионами K~4*10-4 [3], хотя это скорее показатель того, насокльок сильно эта хрень всасывает анионы, как основание в воде оно все-таки имеет pKb~0 [4], что даже сильнее, чем гидроксиды щелочных металлов.
[1] https://pubchem.ncbi.nlm.nih.gov/compound/guanidine#section=Top
[2]https://en.wikipedia.org/wiki/1,8-Bis(dimethylamino)naphthalene
[3] https://pubs.acs.org/doi/abs/10.1021/je9008969
[4] https://books.google.com.ua/books?id=10m3BgAAQBAJ
>>42633
>Сразу уронил давления, погрузился в запредельную кому. Ничего не помогло. ИВЛ, детоксикаци, все попробовали. Ночью умер. Умер нужным, молодым, крепким.
Уровень рашки или даже выше. Сами врачи не знают, что произошло, просто стараются не палиться. У вас труп - вы и разбирайтесь, что там было. "Я съел конфету, мне очень понравилось. Отгадай, какого она вкуса" - охуительные истории.
Электронный захват.
Перекат: >>443094 (OP)
Перекат: https://2ch.hk/sci/res/443094.html (
Перекат: http://arhivach.cf/thread/374528/
Перекат: >>443094 (OP)
Перекат: https://2ch.hk/sci/res/443094.html (
Перекат: http://arhivach.cf/thread/374528/
Перекат: >>443094 (OP)
Перекат: https://2ch.hk/sci/res/443094.html (
Перекат: http://arhivach.cf/thread/374528/
Вы видите копию треда, сохраненную 3 октября 2018 года.
Можете попробовать обновить страницу, чтобы увидеть актуальную версию.
Скачать тред: только с превью, с превью и прикрепленными файлами.
Второй вариант может долго скачиваться. Файлы будут только в живых или недавно утонувших тредах. Подробнее
Если вам полезен архив М.Двача, пожертвуйте на оплату сервера.