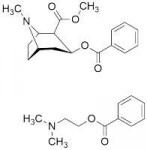
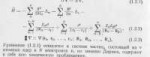Вы видите копию треда, сохраненную 14 февраля 2019 года.
Можете попробовать обновить страницу, чтобы увидеть актуальную версию.
Скачать тред: только с превью, с превью и прикрепленными файлами.
Второй вариант может долго скачиваться. Файлы будут только в живых или недавно утонувших тредах. Подробнее
Если вам полезен архив М.Двача, пожертвуйте на оплату сервера.
Перекат из >>438819 (OP) , архивач: http://arhivach.cf/thread/374527/
Лауреаты нобелевской премии по химии и их достижения (и тренды развития науки), вот тут:
https://ru.wikipedia.org/wiki/Список_лауреатов_Нобелевской_премии_по_химии
Кто хочет вспомнить химию или ищет книгу - тут посоветовали "Общая химия. Глинка Н.Л".
Скачать в PDF можно здесь (44,1 МБ): http://www.200ballov.com.ua/files/chem/glinka.pdf
Также, "Начала Химии" Кузьменко Н. Е, вот настоящий труЪ-учебник для продвинутой школьной программы.
Вот пару картинок с таблицами Менделеева. Пик4 - цикл Кребса.
Вот ещё пикча побольше, кому для плакатов - она сюда просто не лезет:
http://ogoom.com/uploads/posts/2011-05/ogoom.com_1305370963_mendeleev1.jpg
Также оставлю здесь расширенную таблицу химических элементов, где есть даже Унбигексий:
https://ru.wikipedia.org/wiki/Расширенная_периодическая_таблица_элементов
И ссылку на таблицу нуклидов на английской википедии, там видно типы распадов:
https://en.wikipedia.org/wiki/Table_of_nuclides_(segmented,_narrow)
https://en.wikipedia.org/wiki/Category:Lists_of_isotopes_by_element
Потому что здесь: https://ru.wikipedia.org/wiki/Таблица_нуклидов
По каждому конкретному элементу это поле нужно допиливать.
https://ru.wikipedia.org/wiki/Шаблон:Периодическая_таблица_по_изотопам_элементов
Вот, например можно сравнить внизу таблицы:
https://ru.wikipedia.org/wiki/Изотопы_кислорода
https://en.wikipedia.org/wiki/Isotopes_of_oxygen - тут видно тип распада, каналы распада и вероятность.
 420 Кб, 640x360
420 Кб, 640x360Я бросил читать лет в 15, а сейчас 33. По теории поля, я даже толком не знаю что это такое. Любая масса, планета или гиря, искажает пространственно-временной континуум. Прочие предметы проваливаются в эту "воронку". То есть притяжения как такого нет, там немного другая схема. Я когда начинал понимать подобные вещи, просто в какой-то момент дропал, чоб не становиться слишком умным. У меня и проблемы с социумом, а если я начал бы вслух подобные вещи произносить, то это был бы фейл. Олсо в 18 лет загремел в дурдом с шизой, и потом еще несколько госпитализаций было.
>У меня и проблемы с социумом, а если я начал бы вслух подобные вещи произносить, то это был бы фейл.
Кто тебя заставит "подобные вещи" вслух произносить?
>Олсо в 18 лет загремел в дурдом с шизой
А, дак ты шизик. Тогда всё понятно, голоса.
>Скачать в PDF можно здесь (44,1 МБ): http://www.200ballov.com.ua/files/chem/glinka.pdf
ЕГГОГ
 46 Кб, 453x604
46 Кб, 453x604>Тогда всё понятно
Ты не понял.
Пойду я про ТО наверну научпопа, а то чую не то совсем накатал.
>glinka.pdf
>ЕГГОГ
Качал когда-то, нашёл на винте, залил с диска вот сюда. http://rgho.st/8HBtSgZxd
Файл будет доступен к закачке 90 дней. После закачки, обзови его так: glinka_obshaja_himija.pdf
Чтобы вы себе представляли размеры частиц,
оставлю здесь видео, про сравнительные размеры атомов в веществе,
про сравнительные размеры ядер атомов по отношению к атомам,
и про плотность ядра.
https://www.youtube.com/watch?v=4LmtPhG5YsM
Также, хочу отметить, что планковская плотность, состоящая из констант,
имеет значение 5,1·10^96 кг/м3: https://ru.wikipedia.org/wiki/Планковская_плотность
Что на 79 порядков больше плотности ядра 4·10^17 кг/м3
(то есть в около 10^79 степени раз она больше, так как при перемножении - показатели степени складываются).
Для сравнения — количество атомов в наблюдаемой Вселенной составляет по разным оценкам от 4 × 10^79 до 10^81,
то есть в 10^40 раз меньше числа Шеннона. https://ru.wikipedia.org/wiki/Число_Шеннона
Вот ещё одно видео, https://www.youtube.com/watch?v=fzEE32YHYhY
где наглядно видно, что размер размер атома цезия - чуть мене 1 нанометра,
а протона и нейтрона около 1 фемтометра (что почит в миллион раз меньше).
Раз ты такой квантовый весь, не забудь качнуть глинку - и можешь увлечься квантовой химией.
QMC@Home — расчёты с использованием метода Монте-Карло в квантовой химии.
Почему серная кислота, при растворении в воде, выделяет теплоту? Что происходит в растворе, что он адово вскипает? То есть что именно обуславливает столь высокую гигроскопичность, вообще, серняги?
Просто, вроде бы, такой простой, школьный вопрос, кислоты с изученными вдоль и поперек свойствами, а популярного ответа в гугле на него нет. Есть только констатация факта - "серная кислота растворяется в воде очень бурно и всегда старается отнять воду." И вот здесь, заметь, уже не имеет особого значения какие соединения там в растворе образуются. Потому что серная кислота гигроскопична настолько, что вбирает воду отовсюду - из пара, из целлюлозы, из Аллаха. То есть весь этот ряд катионов нихуя не имеет смысла в данном вопросе. Имеет смысл только вот это свойство серной кислоты, из-за которого она ПОЧЕМУ-ТО отовсюду забирает воду. Почему?
А то мне там уже это объясняют образованием сотен различных комплексных ионов воды, не давая ответа на этот вопрос.
![14cNYfs7WIP2OQ[1].gif](/sci/big/thumb/443094/15317367173120s.jpg) 8,1 Мб, 310x174
8,1 Мб, 310x174Когда серную кислоту льёшь в воду (не наоборот, а то вода вскипит) - происходит две реакции:
Sulfuric acid (H2SO4) + Water (H2O) → Hydronium (H3O+) + Sulfurous acid (HSO4-)
Sulfurous acid (HSO4-) + Water (H2O) ←→Hydronium (H3O+) + Sulfate (SO42-)
Они расходуют воду, выдавая ион гидрония (гидроксоний). Потому серная кислота - водоотнимающее средство, и может использоваться как осушитель.
На пикрелейтед, серная кислота обугливает кубики сахара до углерода, отнимая воду извнутри молекул сахара.
А почему серная кислота обладает такой реактивностью по отношению к воде? Чем это обусловлено?
Только из-за высокой степени диссоциации по обеим ступеням? То есть сам остаток so4 никак не обуславливает эту гигроскопичность? Это не из-за него серная кислота водоотнимающая, а из-за двух легко отщепляющихся протонов?
Потому что серная кислота в концентрированном виде — довольно сильный окислитель.
И первая реакция, заметь, идёт необратимо. Она, скорее всего и является экзотермичной.
А вторая - обратимо.
>>43249
Ну растворишь ты в воде какую-нибудь соль, тот же сульфат натрия,
получишь свой сульфат ион. Где гигроскопичность-то?
>Это не из-за него серная кислота водоотнимающая, а из-за двух легко отщепляющихся протонов?
Да, скорее всего. К тому же она ещё и растворяется в этой воде.
Сам же ион гидроксония - распадается так, с выделением реакционно-способного атомарного водорода:
H3O+ + e− → OH + H + H
H3O+ + e− → H2O + H
H3O+ + e− → OH + H
Но для этого нужны электроны.
>ион гидроксония - распадается так, с выделением реакционно-способного атомарного водорода
Атомы водорода вылетают из раствора в виде пучков протонов.
Конц. серная кислота слабодиссоциирована, но те протоны, что надиссоциировались, сольватированы только молекулами серной же кислоты (т.к. воды нет). Эта сольватация плохая. В итоге, такие сольваты более реакционно-способны, чем гидроксоний, потому что при реакции требуется затрачивать гораздо меньше энергии на разрушение сольвата и больше тепла выделяется "наружу". При добавлении воды сольватация протона серной кислотой почти необратимо сменится сольватацией водой (гидроксоний), потому что последний более устойчивый и менее реакционно-способный.
Вот ты заебись пояснил, данный момент. Благодарю.
>>43252
> И первая реакция, заметь, идёт необратимо. Она, скорее всего и является экзотермичной.
И ты тоже.
Вы вообще согласны друг с другом? Алсо еще один вопрос в моём же посте - почему so4 является таким сильным окислителем? То есть понятно, что там целых 4 кислорода и сера в степени окисления +6, и заряд иона -2, это значит, что еще сильнее окислить этот ион просто не получится? И как происходит процесс окисления данным ионом? Он принимает электроны, отщепляя кислород? Почему кислород отщепляется?
В Москве есть магазины, продающие пачки по 70 гр. \ 300р., может кто-нибудь такое в Спб видел?
Может, проще получить?
Только надо серная кислота. Упаришь её - получишь концентрированную.
1. (150°C) NaCl + H2SO4 (конц.) -> NaHSO4 + HCl↑
2. Затем, хлороводород по трубке - подаёшь на алюмний:
2Al + 6HCl → 2AlCl3 + 3H2
Можно и без серной кислоты - электролизом NaCl:
Сначала так: 2NaCl + 2H2O ± 2е- → H2 + Cl2 + 2NaOH
затем так: H2 + Cl2 → 2HCl (если ток переменный и хлор с водородом перемешан),
ну а потом - вот так: 2Al + 6HCl → 2AlCl3 + 3H2
Или же, при постоянном токе - хлор отдельно соберёшь, и спалишь в нём алюминий:
2Al + 3Cl2 → 2AlCl3. Выше 800°C не грей, а то вот что получается: 2Al + AlCl3 ⇄ 3AlCl
Поэтому, лучше в соляной кислоте просто алюминий растворить.
 86 Кб, 900x450
86 Кб, 900x450Ты неправильно задал вопрос. Тебе надо было спросить как получить и тебе бы сразу ответили что ты дурак и проще купить там-то.
>Алсо еще один вопрос в моём же посте - почему so4 является таким сильным окислителем? То есть понятно, что там целых 4 кислорода и сера в степени окисления +6, и заряд иона -2, это значит, что еще сильнее окислить этот ион просто не получится? И как происходит процесс окисления данным ионом? Он принимает электроны, отщепляя кислород? Почему кислород отщепляется?
Всё упирается в термодинамику. Сульфат окислитель, по тем же причинам, что и нитрат окислитель. При этом проявляется эта сила, только в довольно кислой среде по двум причинам.
1) Чем кислее среда, тем больший потенциал создавала бы гальванический элемент с сульфатом на катоде.
2) Представь себе сульфат ион, у тебя симметричный тетраэдр. К сере не подобраться никак, будешь упираться в кислороды, но в конц серной кислоте, проходят такие равновесные взаимодействия:
H2SO4+H2SO4+HSO4-+H3SO4+
H2SO4+H3SO4+=HSO3++H3O++HSO4-
и т.д.
Как понимаешь HSO3+ треугольная уже частица, к которой легко подойти, и плюс, она очень любит цепляться за электронные пары, а вскоре и вообще отбирать их уплывая в виде HSO3-
Ну и не разговаривай себе. А мир субстанциональный.
>>43321
Электролиз раствора хлорида натрия постоянным током, не такой уж и геморройный.
Надо только хлор отвести от анода в алюминий какой-нибудь трубкой.
Реакция хлора с порошковым алюминием протекает уже при 25 градусах,
2Al(порошок) + 3Cl2 → 2AlCl3 Условия: 25 °C
Но можно его прогреть или амальгамировать ртутью или галлием.
Кстати, хлорид галлия - легкоплавкий, и расплавится при 78 градусах.
Если есть хлорид галлия - можешь сделать электролиз расплава с алюминиевым анодом.
От меня могу назвать Невареактив и Ленреактив.
Бро, а ты эти реакции сам проводил? Или может видел их где-то?
Получить безводный хлорид алюминия очень сложно, тем более в домашних условиях.
Спасибо конечно за ответ, но эта тема уже, вроде как, была раскрыта на другом хим. форуме и ответ не удручающий.
Вопрос все еще остается открытым - видел ли кто-нибудь в продаже безводный хлористый алюминий? Или может у кого-нибудь может отсыпать немного, за адекватную цену?
И еще вопрос - кто-нибудь пробовал получать серную кислоту путем выпаривания электролита? Он так же продается в машинных магазинах. Конечный продукт должен получиться 80%+ концентрации, может каких советов дадите.
Силиконовые трубки при работе с ним нельзя использовать?
Что можете посоветовать, чтобы вся квартира не провоняла,если нет нормальной вытяжки ?
Часто на бутылке пишут состав.
Пробовал, под конец он желтеет и начинает идти какой-то дым. Не знаю, какая концентрация достижима, но спички у меня обугливала.
Вытяжка - сильный настольный вентилятор, выдувающий в окно, и прямо за ним все делать.
Просто состав на бутылке - это ты про воду или про кислоту? Просто на бутылке с дистиллированной водой писали только что-то про какой-то там двухступенчатый способ очистки. Т.е. нет даже % примесей в воде.
Что касается состава кислоты - то там, как и на растворителях, часто пишут какую-то хуйню. На 646 растворителе, из которого часто достают толуол, часто пишут что-то типо "ароматические углеводороды" или "летучие спирты". На электролите, наверное, пишут тоже что-то подобное.
Да, с вытяжкой думал делать именно так. А с бромоводородом такой способ подойдет, не знаешь?
>Бро, а ты эти реакции сам проводил? Или может видел их где-то?
Галлий дорогой, с хлоридом галлия дело не имел.
Я просто загуглил реакцию хлора с алюминием, и глянул пару видео про горение металлов в хлоре.
В лабораторных условиях, в малых количествах его так и получают, обычно.
Либо же действием сухого хлороводорода на алюминий.
>Получить безводный хлорид алюминия очень сложно, тем более в домашних условиях.
Даже тут написано об этом:
https://msd.com.ua/texnologiya-mineralnyx-solej-udo-brenij-pesticidov-promyshlennyx-so-lej-okislov-i-kislot/bezvodnyj-xloristyj-alyuminii/
Глянь, там ещё есть инфо, про промышленное производство безводного хлорида.
В частности - хлорирование алюминиевого порошка газообразным хлором в расплаве, содержащем FeCl3 (306 °C плавление у него).
Должно выпадать железо: Al + FeCl3 → Fe + AlCl3 Реакция протекает при температуре около 200°C.
https://www.youtube.com/watch?v=l3xiPLrxSxI
Дальше, можешь перегнать хлорид алюминия, пары по трубке отвести, производя потом либо десублимацию либо конденсацию
в холодном, герметичном хранилище.
При 183 °C, хлорид алюминия возгоняется (сублимация), а под незначительным давлением 2,5 атм. - он плавится при 192,6 °C.
Выше, я подчеркнул слово "порошок", потому что у цельного куска алюминия - будет оксидная плёнка в расплаве.
Но что мешает пропустить пары хлорида железа (кипит при 315 °C) через расплав алюминия (660,3°C)?
При температуре около 500°C может протекать реакция 2FeCl3 ⇄ 2FeCl2 + Cl2
При этом свободный хлор - должен хлоровать алюминий,
а FeCl2 тоже с алюминием должен дать тоже хлорид алюминия по вот этой реакции: 3FeCl2 + 2Al = 3Fe + 2AlCl3
Всё это можно делать в стекле. Но выше 800 градусов уже не грей, я писал об этом выше.
>Вопрос все еще остается открытым - видел ли кто-нибудь в продаже безводный хлористый алюминий?
На, у этих закажи.
http://bsk-chemic.regtorg.ru/catalog/prodam_aljuminij_hloristyj_bezv_99-299694.htm
http://bsk-chemic.blizko.ru/products/73825227-alyumini_khloristy_bezv_99
http://bsk-chemic.com/xlorid
http://www.chemline.ru/catalog/1/2/686.html
Синтезатор-кун.
Бро,их уже видел и даже писал им - они работают только от 1 кг.
Если других вариантов не будет - буду брать у них.
Очень сомневаюсь, что в лаб. условиях его получают именно так.
Сравни полученный продукт с тем, как выглядит безводный хлор. алюм., мне нужна хоть какая-то чистота продукта.
Спасибо конечно за ответы, но я сомневаюсь в такой методе.
Благодарю, по большей части, мне стало понятно.
Че скажете, хикканы?
Дорогая коробка
>Поэтому, лучше в соляной кислоте просто алюминий растворить.
Он не будет безводным. Более того, производные алюминия и других подобных элементов крайне склонны к гиролизу. Безводные галогениды полуают обработкой оксидов хлорирующими реагентами вроде фосгена или хлором в присутствии восстановителей.
А то как-то достало официально заказывать реактивы в Алдриче, Альфе и у прочих барыг, ждать по три месяца и получать банку реактива на 5 грамм 95% чистоты за дохуилиард денег. Хотелось бы заказать у китайцев, но боюсь что дядюшка Ляо на пофиге мне все что угодно отправит, а я потом пойду по стопам того чувака, который растворитель для солнечных батарей заказывал.
>Если вы не можете этой реакции провести, то нахуй вы вообще химией занимаетесь? Хотя, кило таким способом сделать проблематично, соглашусь.
>
Не думаю, что ты получил именно безводный ал. хлор.
Ну вот, а вы пиздели: "дебил", "свой мир", "геморно", "сложно". Уебаны, блядь.
А чел взял, сам получил эту хуйню свою, и ещё и меня зацитировал, лол.
Чувак, запости свою эту шляпу в ютуб, а то не гуглится, бля.
>>43571
А чё это его дегидратировать, если алюминий взаимодействовал с безводным хлороводородом?
 255 Кб, 479x479
255 Кб, 479x479>алюминий взаимодействовал с безводным хлороводородом?
Представляю себе установку для этого дела.
Аххахх, а осушить тем же хлоридом кальция каким-нибудь не судьба?
А как в Алдриче и Альфе заказывать от физ. лица? Какую контору не найду, они хотят работать только с компаниями. И если уж на то пошло, часто слышу, что китайцы реактивы производят, а как с ними работают, как их искать для заказа, нужен ли посредник или что?
>А как в Алдриче и Альфе заказывать от физ. лица?
На этот вопрос не отвечу, т.к. работаю в НИИ и все химикаты заказываю через институт.
Т.е. как таковой проблемы доступа в реактивам нет, проблема есть в цене. Вот например есть один прекурсор, с которым мы не работали, но есть желание попробовать. По опыту я знаю, что для мало-мальской серии синтезов его потребуется грамм 5. А в Алдриче он 16к рублей за 500мг, т.е. 160к за 5 грамм. Заебись, чо.
А китайцы предлагают дешевле и отправка обычной почтой. Проблема в том, что отдел закупок при упоминании китайцев делает морду тяпкой: они работают либо с Алдричем/Альфой/TCI, либо с РосПромХимТоргСнабНаеб, который заказывает у этих же китайцев но с 500% накруткой.
Как покупать - хрен его знает, сам еще не пробовал, вроде много чего есть на алибабе, там ясное дело через посредника.
список гуглится первой ссылкой по запросу "список запрещенных веществ"
никак. искать барыг и надеяться, что они не кинут, т.к. работать они будут по предоплате, а поставка 3+ месяца
>который растворитель для солнечных батарей заказывал
Ну да ГБЛ ведь только безобидный растворитель хуле
Вот, возникла мысль - а вообще есть какая-нибудь качественная реакция на именно этот подклас жирных кислот?
Очень сомневаюсь, что он получил безводный хлористый алюминий хоть какой-то чистоты. Провести такую реакцию и нормальным результатом очень сложно по многим причинам, из-за температур, окислению на воздухе и т.п.
Если ты это тот анон, который на мой вопрос (про покупку безводного ал.хлор.) отвечал первыми запросами из гугла - то тебе правильно писали. Может кто-то из задающих здесь вопросы сам ничего перед этим не ищет и поэтому твоя им нужна твоя помощь, но лично я спрашивал про ПОКУПКУ это реагента, т.к. про сложность его синтеза знал заранее.
Вопрос всё еще остается открытым - может кто-нибудь знает магазины в Спб где продается безводный хлористый алюминий?
Интересуют термостойкие колбы, алонжи и т.п.
В чем суть: В 0.2М растворе фосфористой кислоты (H3PO3) концентрация ионов H+ равна 0.05 моль/л. Вычислить константу диссоциации H3PO3, предполагая, что второй протон не отщепляется.
Окей, пишем уравнение
H3PO3 <=> [H+] + [H2PO3-]
Раз H+ 0.05 моль на литр, то и H2PO3- ионов столько же.
Ебошим уравнение:
k1 2 = k2 0.05 0.05
Kd получается 1.2510^-2. В ответах 1.67*10^-2. Где я неправильно мыслю? В примерах к параграфу решение подобного рода задач не рассматривается, только всякое на скорость.
Бля, мерзкая разметка сожрала значки умножения в уравнении. Ну, впрочем, там понятно.
Ты просто неправильно посчитал. Концентрации 0,05 0,05 и 0,15.
Подставляешь и получаешь ответ.
А, или выходит, что 0.15 моля не диссоциировало, а 0.05 развалилось. Тогда да, похоже на правду.
>что 0.15 моля не диссоциировало
Да, это так. Когда пишут "концентрация раствора кислоты", имеют ввиду суммарную концентрацию формы, а не равновесную.
Спасибо анонче. Сложновато без преподавателей изучать местами.
Нигде. Есть росхим и авито.
Ну... это совсем разные вещи.
ОВР это "реакция". А донорно-акцепторное взаимодействие это взаимодействие. Причем реакции, которые отвечают донорно-акцепторному взаимодействию не ОВР.
Книги почитай.
То есть, все реакции - это взаимодействия, но не все взаимодействия - реакции ?
ОВР - это класс химических реакций. Донорно-акцепторное взаимодействие - это один из механизмов протекания ОВР. Так понятнее?
>ОВР - это класс химических реакций. Донорно-акцепторное взаимодействие - это один из механизмов протекания химических реакций вообще
Фикс.
Реакции, это наша запись того (порой обобщенная, и с пропуском элементарных стадий), что происходит с веществами.
А взаимодействия, это то, что происходит между молекулами или частицами. Это то, из чего состоят реакции.
ОВР - любые реакции, при которых меняется формальная степень окисления.
Донорно-акцепторное взаимодействие - образование аддуктов за счёт обобществления пары электронной пары. Формальная степень окисления, какя понимаю, не меняется.
Химики, скажите, а есть где нибудь книжки, в которых вы описываете свои будни? У математиков, физиков, геологов такого дохуя, а про химиков?
Как насчёт автобиографий? Тот же Разуваев писал о своих злоключениях.
"Современная Органика" Тернея.
https://www.rlsnet.ru/mnn_index_id_1484.htm
Химическое название:
Тринатриевая соль лимонной кислоты
Брутто-формула:
C6H5Na3O7
Нужно даже "Натрия цитрата дигидрат"
смешай соду и лимонную кислоту в водном растворе, после окончания реакции раствор выпари.
Найди формулу лимонной кислоты, замени три её кислотных водорода на натрий, добавь 2 молекулы кристаллизационной воды. Мне лень это делать.
Дядя майор, опять вы?
Намного ли сложнее варить мет в мультиварке?
Анон, какая безопасная концентрация серной кислоты (чтобы не обжигало руки и одежду)?
Хочу сделать паяльную кислоту для оцинковки в домашних условиях. Кислоту взял в автомагазине в виде электролита для аккумуляторов. Но мне кажется что с неразбавленной лучше не работать. До какой концентрации разбавлять? Как проверить, что стала безопасной (не палец же окунать)?
А в салициловую хуйни соды с запасом, учитывая желудочный сок и желчь, эти кислоты сода тож должна покрыть, чтобы получившаяся хрень опять в салициловую кислоту не превращалась внутри тебя.
Лучше её ещё смешивать с остальным пойлом, она станет не такой едкой.
Снова решаю херню, на этот раз совсем тривиальную, но промахиваюсь мимо ответа где-то на пяток процентов. Хочу разобраться где я облажался в этот раз.
Суть задачи в том, что в нормальных условиях (20 градусов, 1 атм) растворяют в воде хлороводород для получения соляной кислоты. В этих условиях в одном объеме воды растворяется 450 объемов хлороводорода. Найти надо массовую долю хлороводорода, растворенного в воде.
Решаем (для простоты будем считать, что воды литр, а газа 450 литров):
Сперва поищем сколько же там молей этого сраного газа получается.
450 / 22.4 = 20.08 моль
Дальше получаем массу этих молей (молярная масса хлороводорода 35.5 + 1 = 36.5):
20.08 x 36.5 = 733.25 грамм.
А воды у нас литр, значит 1000 грамм.
Общая масса жижи 1733.25 грамм. Следовательно массовая доля хлороводорода 733.25 / 1733.25 = 0.423 (42.3%).
В ответе 40 с небольшим процентов. Какого хуя?
Ты не учёл данную в задаче температуру. 22,4 - объём одного моля идеального газа при 0, а не 20 градусах.
Похуй, это лечится.
Слушай, ну я не такой же тупой, чего ты в самом деле?
И кстати, Дирак немного ошибся, так как релятивизм играет довольно значимую роль для части атомов.
1 [копейка^2] = 0.0001 [рубль^2];
25 [копеек^2] =0.0025 [рублей^2] !== 1/4 [рублей^2] = 1/400 [рублей^2];
√(1/400 [рублей^2]) = 0.05 [рублей] = 5 [копеек].
Про что именно?
Ну ЭО показывает способность притягивать электроны, собстно оно должно коррелировать с активностью элемента.
В третьем равенстве ошибка.
Цезий имеет очень маленькую ЭО, и очень активный элемент. Фтор имеет наибольшую ЭО, и тоже очень активный элемент.
Что происходит и может ли при охлаждении горячий раствор вернуться к синей окраске?
Образуется комплекс, которое распадается при нагревании. Ну и должен образовываться опять при охлаждении.
Ну так в том то и дело - металлы не притягивают электроны, а у меди это получается просто хуже всех, вот она и наиболее электроотрицательна
Ну есть и исключения, ЭО для неметаллов подходит. Конечно надо учитывать радиус электронных оболочек с валентными электронами и в целом радиус атомов. И еще кучу всякой хуйни.
Это ж двач, дай попиздеть о всякой херне. У меня печаль и очередная ебанутая задача (inb4 я ебанутый) не сходится, вот мне и скучно.
Да ну, нахер, мне стыдно постить сюда задачу про смешивание двух растворов и расчет объема для получения требуемой концентрации.
Водку не можешь смешать?
Вероятно, раскрытием цикла ТГФ с последующим окислением.
Inb4: поджечь в пакете пирофорное железо с образованием окалины. Но это не дешево.
А в чём траблы-то?
Нет возможности в -78°С? Так надо описать в посте, какие есть возможности, аппаратуры, ингредиенты, из всего этого можно будет подобрать человеческий синтез.
Если просто свободный кислород, можно засыпать в мешок известняка например, он весь воздух со свободным кислородом вытеснит, а тот что в составе известняка с луком уже особо не реагирует, тяжеловато только, зато дёшего.
Чувак, притяжение таки есть. Согласно квантовой теории поля, гравитация - это такой же тип взаимодействия, как и сильное, слабое и электромагнитное, т.е. осуществляется обменом виртуальными частицами - являющимся квантами того или иного поля.
Ставишь брагу, газоотводную трубку кидаешь в мещок, углекислота тяжелее воздуха, профит.
Да я знаю как это называется, и предполагаю что используется оно для дистилляции. Я не могу понять зачем, сверху могут понадобиться два "выхода"?
Ну вот в насадку Вюрца, например. Но здесь отвод вверх, а у Вюрца вбок под углом. Есть какие-то примеры установок, где эта хреновина незаменима тем же Вюрцом?
Изопропиловый спирт?
Мы в лаборатории всегда сушили органику либо хлоридом кальция, либо сульфатом натрия.
http://web.hs-merseburg.de/~ag-vt/ADS_Trocknungsmittel.pdf
Ок, этого не знал. Тогда смотри сюда, на 8-ой странице список органики и чем её сушить. Из этого списка ИПС можно сушить: Оксидом кальция, магнием и молекулярными ситами с диаметром в 3 Å
Алкоголь же. Натрием можно сушить только что-то почти инертное, углеводороды, там пентан, октан, циклопентан или тоже бензол. Тому же бензолу нафиг не нужен лишний электрон натрия, поэтому и реакции не будет, а значит можно и сушить.
С алкоголем выйдет алкоголят натрия.
А алкоголят магния типа не мешает?
 46 Кб, 681x540
46 Кб, 681x540Сцинтиллятор - сульфид кадмия/цинка/неба/аллаха
Аноним,в думалку то надо не только кушац. Всем что гигроскопично и не реагирует. То есть да,можно. Ещё можно безводным сульфатом меди,там его ещё и начинают в гействе обвинять,как воду впитает
магний лучший. кипятишь над избытком и отгоняешь. ипс мерзко сушить
Да, erowid знаю. Просто схоронить хотелось. Ну и вообще, досадно, что первая половинка на русском есть, а вторую выкинули как будто на хуй не нужо, фашисты проклятые.
Жаль.
>>45064
Мне тоже эта хуйня понадобилась, добавить в колбасный фарш, а хуй его знает как получить.
Ну кароч сода NaHCO3+C6H8O7 → H2O +?
Я Хз как дорешать и какие пропорции брать этого варева, чтоб прореагировало всё вещество, сода и лимонная кислота в фарше нахуй не нужны, можете помочь с расчётом пропорций?
>>47136
Спасибо! Классный сайт, накачал литературы, сидел вспоминал, потом на него наткнулся блядь. Ох и тяжко химия шла, это просто пиздец, есть некоторые непонятки:
- в формуле указан кусок через знак умножения, как я нагуглил это кристаллогидрат, но что странно в каталоге CAS лимонная кислота не фигурирует как кристаллогидрат, а по другим формулам получаются другие пропорции.
http://www.caslab.com/Citric_acid_anhydrous_CAS_77-92-9/
- Нашёл похожий патент на получение аскорбата натрия, таж хуйня но без одного кислорода, и технология дана, и формулы есть, но что странно, так то что в патенте описана методика осаждения конечного продукта в этиловом спирте (как я понял аскорбат в нём не растворяется и кристаллизуется). Нахуя это делается, ну то есть если мы ч0тко рассчитали пропорции, и там хуяк, чуть-чуть погазовало, а в результате у нас бульончик с готовым раствором в воде, только выпарить и всё. Или я не прав, и там остаётся хуй его знает какой бульон, и надо осаживать прореагировавшее вещество?
http://www.findpatent.ru/patent/256/2562516.html
-Можете глянуть пикрелейтед, в реальном мире такие формулы компилируются, или я хуйню написал, мне повезло и всё сошлось? Я тут ХЗ, в калькуляторы вроде забивается, но это не показатель.
Многие вещества в твёрдом виде существуют в виде разных кристаллогидратов. Лимонная кислота может быть моногидратом, как я написал, а может быть безводной. В продуктовых обычно продаётся моногидрат, безводную можно купить в химмаге.
У моногидрата CAS 5949-29-1
Цитрат натрия, кстати, кристаллизуется как дигидрат, так что если будешь выпаривать раствор, твердого вещества выйдет больше, чем рассчитано безводного цитрата.
Про аскорбат натрия: он очень легко окисляется воздухом. Кроме того, я подозреваю, что он обладает очень высокой растворимостью, как у всех подобных веществ, и вряд ли стоек термически. В результате выпаривать придётся в вакууме, при небольшой температуре и продув предварительно азотом. Вероятно, спиртом проще.
ХЗ что там у тебя на скриншотах. Уравнение с аскорбатом верное, аскорбиновая кислота - одноосновная.
>аскорбиновая кислота - одноосновная
Двухосновная. Но по второй ступени диссоциация очень слабая: K2=1,6*10-12
А да, на английской вики сказано про две формы кислоты
>It can exist either in an anhydrous (water-free) form or as a monohydrate.
>The anhydrous form crystallizes from hot water, while the monohydrate forms when citric acid is crystallized from cold water.
>The monohydrate can be converted to the anhydrous form at about 78 °C.
Соберу термоконтроллер, попробую погреть лимонку, если ничего не изменится по весу, знач и была безводная.
Что странно, между цитратом и аскорбатом разница в хранении лишь в том что именно цитрат почему-то годен всего месяц после вскрытия пачки. Может аскорбат не так быстро и окисляется. Я хз короч, нихуя не уверен в результате и буду действовать методом дегустации полученных растворов в сравнении с покупной хуйней.
Похмелье будет. Он окисляется организмом до ацетона, а после не может окислиться до кислоты обычным путем. Ибо кетон а не альдегид. По слухам, лаборант пробовал бухнуть ради эксперимента. Неделя похмелья как итог.
Логично, что не можешь. Потому что это не насадка Кляйзена, а двурогий форштосс. Элемент ветвления, не больше. Удобно заменяет колбу Бунзена в комбинации с круглодонкой и Шоттом.
Разве растения умеют синтезировать элементы, а не просто пересобирают то что уже есть в природе?
Растения умеют концентрировать элементы. А в природе есть всё.
Подскажите, как очистить платину? Слышал, что в какой-то кислоте можно подержать. Но в какой? Есть ли ещё способы?
Царская водка, может?
>платину
От органики или аноргана отчищать? С чем была в контакте? Тебе аггресивную или шадящую отчистку?
Уксусная кислота восстанавливается до этанола алюмогидридом лития. На хера это делать - непонятно.
Кстати, есть годные способы синтеза алюмогидрида лития? Он в конском количестве разных синтезов используется, хотелось бы заиметь такую штуку.
Способы синтеза есть, только ими никто не занимается, потому что готовый алюмогидрид найти проще, чем гидрид лития.
>Уксусная кислота восстанавливается до этанола алюмогидридом лития.
>На хера это делать - непонятно.
Чтобы микробиологически - медленный процесс уксуснокислого брожения не проводить.
>Кстати, есть годные способы синтеза алюмогидрида лития?
Действием хлорида алюминия на суспензию гидрида лития в эфире:
4LiH+AlCl3 -> Li[AlH4]+3LiCl;
>>47869
>Способы синтеза есть, только ими никто не занимается, потому что готовый алюмогидрид найти проще, чем гидрид лития
А чё бы не синтезировать этот гидрид лития?
Литий реагирует с водородом при температуре выше 440 °С с образованием гидрида.
При 600—630°С реакция протекает очень бурно.
Поскольку литий и гидрид лития выщелачивают кремний из стекла и фарфора,
а пары гидрида при температуре синтеза создают значительное давление,
при проведении реакции следует соблюдать особые меры предосторожности.
Лучше всего синтез проводить в фарфоровой трубке, облицованной внутри на протяжении всей обогреваемой зоны листовым никелем.
Литий гидрируют в лодочке из листового железа, полученного электролизом.
Для полной очистки железных и никелевых частей установки от оксидов обогреваемую зону, вместе с лодочкой нагревают до 800 °С
в потоке чистого сухого водорода (водород, полученный электролизом,
пропускают над палладированным асбестом при 300 °С, высушивая при помощи CaCl2 и Р4О10).
После охлаждения, литий очищают парафиновым маслом, промывают безводным эфиром, помещают в железную лодочку,
поверхность которой полностью очищена от оксидов, и во влажном состоянии как можно быстрее вносят в установку.
Вакуумируют, нагревают до 200°С для удаления остатка растворителя, пропускают через установку поток водорода и продолжают нагревание.
При 440 °С начинается поглощение водорода, которое энергично протекает при 600—630 °С.
В этот момент устанавливают давление водорода 400—500 мм рт. ст., затем быстро нагревают установку до 700°С.
Эту температуру не следует превышать, так как в противном случае гидрид лития возгоняется.
Реакция заканчивается за 10—20 мин.
Дают установке охладиться в потоке водорода и затем вытесняют водород сухим воздухом.
Продукт удаляют из лодочки заостренным стальным шпателем.
>>47943
Из дейтерия получают термоядрённый литий-6 по ядерной реакции: d(α, γ)6Li
Ну и для дейтерида лития-6 тоже дейтерий нужен...
>Уксусная кислота восстанавливается до этанола алюмогидридом лития.
>На хера это делать - непонятно.
Чтобы микробиологически - медленный процесс уксуснокислого брожения не проводить.
>Кстати, есть годные способы синтеза алюмогидрида лития?
Действием хлорида алюминия на суспензию гидрида лития в эфире:
4LiH+AlCl3 -> Li[AlH4]+3LiCl;
>>47869
>Способы синтеза есть, только ими никто не занимается, потому что готовый алюмогидрид найти проще, чем гидрид лития
А чё бы не синтезировать этот гидрид лития?
Литий реагирует с водородом при температуре выше 440 °С с образованием гидрида.
При 600—630°С реакция протекает очень бурно.
Поскольку литий и гидрид лития выщелачивают кремний из стекла и фарфора,
а пары гидрида при температуре синтеза создают значительное давление,
при проведении реакции следует соблюдать особые меры предосторожности.
Лучше всего синтез проводить в фарфоровой трубке, облицованной внутри на протяжении всей обогреваемой зоны листовым никелем.
Литий гидрируют в лодочке из листового железа, полученного электролизом.
Для полной очистки железных и никелевых частей установки от оксидов обогреваемую зону, вместе с лодочкой нагревают до 800 °С
в потоке чистого сухого водорода (водород, полученный электролизом,
пропускают над палладированным асбестом при 300 °С, высушивая при помощи CaCl2 и Р4О10).
После охлаждения, литий очищают парафиновым маслом, промывают безводным эфиром, помещают в железную лодочку,
поверхность которой полностью очищена от оксидов, и во влажном состоянии как можно быстрее вносят в установку.
Вакуумируют, нагревают до 200°С для удаления остатка растворителя, пропускают через установку поток водорода и продолжают нагревание.
При 440 °С начинается поглощение водорода, которое энергично протекает при 600—630 °С.
В этот момент устанавливают давление водорода 400—500 мм рт. ст., затем быстро нагревают установку до 700°С.
Эту температуру не следует превышать, так как в противном случае гидрид лития возгоняется.
Реакция заканчивается за 10—20 мин.
Дают установке охладиться в потоке водорода и затем вытесняют водород сухим воздухом.
Продукт удаляют из лодочки заостренным стальным шпателем.
>>47943
Из дейтерия получают термоядрённый литий-6 по ядерной реакции: d(α, γ)6Li
Ну и для дейтерида лития-6 тоже дейтерий нужен...
Если только цинк, то хватит и обычной соляной кислоты.
Если цинк был на поверхности и лежал на воздухе, то могла иметь дело пассивация, тогда я бы физически снёс эту защитную плёнку, а потом уже солянкой. Пусть анон ещё подскажет или мой вариант оценит.
надо установить формулу кислоты
Научись определять интуитивно степени свободы в задачах.
Вот смотри, если тебе дали бы сразу что за кислота и как найти количество NaOH чтобы оттитровать, ты бы быстро решил. Но все значения связаны формулами очень жестко, и поэтому если тебе не дать молярную массу, но наоборот дать количество NaOH, то задача просто перевернется в обратную сторону, оставив все формулы на местах.
Запиши кислоту как H2A, напиши с ней реакцию. Обознать молярку через M, найди молярку, вычисли молярку аниона. Проверь подходит ли какой-нибудь элемент, если в анионе 1 2 3 4 5 6... кислородов... Останется скорее всего один вариант.
спасибо
Валентности довольно примитивный взгляд на химию.
В карбиде бериллия всё нормально с ними. А в карбиде кальция, анион ацетиленид.
[CC]2- ацетилен без двух протонов, частица изоэлектронная N2
понял
>>С алкоголем выйдет алкоголят натрия.
>Который прореагирует с водой. Собственно, один мой знакомый как-то раз перегнал изопропанол над натрием. Алсо, метанол сушат над магнием.
Теперь это будет тред психологической помощи. А она мне нужна, потому что я повсюду вижу людей, вызубривших определения, заезженные закономерности, которые не проверялись, пройдя через пять последних рук.
Наверное, вы знаете такую штуку, как таблица растворимости солей в воде. У нас в кабинете химии висела такая, например. Если вы попытаетесь поискать такую таблицу на английском, то удивитесь - эту инфу преподают как краткий набор правил. В постсовке, естественно, никаких правил никто не изучает, растворимость солей в воде трансцендентна.
Так вот, точно такие же закономерности существуют в растворимости веществ, из которых можно делать выводы о том, что натрием или хлоридом кальция бесполезно сушить спирты, даже если вы не знаете конкретной растворимости в осущаемом веществе.
Константы диссоциации спиртов и воды примерно равны, таким образом, смесь щелочи со спиртом постоянно находится в равновесии с продуктами - водой и алкоголятом. Пока у вас есть щелочь в спирте - у вас будет выделяться вода.
NaOH + EtOH <=> NaOEt + H2O
Откуда возьмется щелочь? Из реакции алкоголята с остаточной водой. Да, некоторую степень осушения натрий дает, но чтобы досстичь 99,9% сухости спирта, нужно уебать в мокрый спирт кол-во натрия, где-то так десятикратное по отношению к кол-ву воды. Это бессмысленная и беспощадная трата натрия, сульфат меди с подобной задачей справляется не хуже, при этом регенерируется, в отличие от металлического натрия.
Приятно видеть на форумах людей, которые уже понимают то, что я выше написал, но по общей картине я вынужден сделать вывод - знание химии в массах находится на уровне тупого повторения заимствованных фраз, теперь у нас имеются операторы лабораторий вместо химиков-исследователей.
>Если вы попытаетесь поискать такую таблицу на английском, то удивитесь - эту инфу преподают как краткий набор правил. В постсовке, естественно, никаких правил никто не изучает, растворимость солей в воде трансцендентна.
Ты это выдумал сам? На любом химфаке тебя так выебут теор. химией и термодинамикой, что ты сможешь ночью все способы предсказания растворимости от простых до сложных рассказать. (если ты конечно поступал чтобы учиться, а не чтобы от армии косить)
Большинство химиков-исследователей уезжают. Поэтому кажется что остаются одни операторы.
А зачем ты накинулся то на него. Он же не говорил что натрием круто сушить. Он лишь сказал мол им МОЖНО сушить. Так как кто-то до него утверждал, мол фигня и не работает.
Сейчас бы проводить ИССЛЕДОВАНИЯ в области очистки веществ, когда все уже до тебя там веками проштудировано.
Всем страждущим по этой теме советую гуглить Purification of Laboratory Chemicals последних изданий.
>Сейчас бы проводить ИССЛЕДОВАНИЯ в области очистки веществ, когда все уже до тебя там веками проштудировано.
>Всем страждущим по этой теме советую гуглить Purification of Laboratory Chemicals последних изданий.
У меня есть последние четыре издания этой книги. Многие описания довольно скудны, сам автор книги не понимает, что происходит в описываемых им методах. Что не удивительно, поскольку методов очистки описано реально дохуя.
>>48596
>На любом химфаке тебя так выебут теор. химией и термодинамикой, что ты сможешь ночью все способы предсказания растворимости от простых до сложных рассказать
Знать много мусора и уметь предсказывать растворимость - это разные навыки. Они там в институтах часто совсем отрываются от реальности. Я общаюсь с действующими и вполне прошаренными химиками, в основном они работают в рашке, некоторые уехали. Вполне возможно, что никто из них не уделяет много времени вопросам растворимости, потому не накопили солидного багажа по теме.
То, что преподается в институтах - это хуета, я могу завалить с пары вопросов практически любого академика-теоретика.
>Большинство химиков-исследователей уезжают. Поэтому кажется что остаются одни операторы.
Я не спорю, что на западе есть несколько реально продвинутых исследователей. Часто это те самые эмигранты.
>Он же не говорил что натрием круто сушить. Он лишь сказал мол им МОЖНО сушить.
Можно овсянкой сушить, кукурузной крупой. Есть дохуя вещей, которые обладают большой поверхностью и способны ненулевое кол-во воды убрать из спирта. Другое дело, что осушение натрием - очень неэффективный способ, и его "знакомый как-то раз перегнал изопропанол над натрием" еще и долбоеб потому, что не проверял кол-во воды после "осушения" - а зачем ты тогда вообще делал осушение по непроверенному методу?
Горит у меня конкретно жопа с того, что я люблю химию, а она загнивает, с одной стороны превращаясь в распил бюджета и примитивные прикладные области, а с другой стороны опять же распил, но уже намного более жирных бюджетов, и такая же толпа блондинок, которые идут учиться в институт, чтобы работать где-то в лабе аналитиком до конца своих дней за неплохую ЗП.
На фоне этого всего загнивает хим теория, которая начинает ориентироваться именно на таких долбоебов. В итоге я читаю какую-нибудь очередную популярную книгу, и нахожу там снова и снова очень скудную информацию, хотя книга и будет называться "продвинутое исчерпывающее расширенное руководство по применению пипеток". Доходит до смешного: некоторые книги выпускаются, как рекламные путеводители по продукции sigma-aldrich, merck, macherey-nagel, и прочих, при этом сам автор явно об этому не говорит.
Огромное кол-во интересных методов разработано в частных фирмах, но не применяются внутри из-за коммерческой неэффективности, при этом и не публикуются для пополнения общей копилки - вот это еще одна печаль.
>Сейчас бы проводить ИССЛЕДОВАНИЯ в области очистки веществ, когда все уже до тебя там веками проштудировано.
>Всем страждущим по этой теме советую гуглить Purification of Laboratory Chemicals последних изданий.
У меня есть последние четыре издания этой книги. Многие описания довольно скудны, сам автор книги не понимает, что происходит в описываемых им методах. Что не удивительно, поскольку методов очистки описано реально дохуя.
>>48596
>На любом химфаке тебя так выебут теор. химией и термодинамикой, что ты сможешь ночью все способы предсказания растворимости от простых до сложных рассказать
Знать много мусора и уметь предсказывать растворимость - это разные навыки. Они там в институтах часто совсем отрываются от реальности. Я общаюсь с действующими и вполне прошаренными химиками, в основном они работают в рашке, некоторые уехали. Вполне возможно, что никто из них не уделяет много времени вопросам растворимости, потому не накопили солидного багажа по теме.
То, что преподается в институтах - это хуета, я могу завалить с пары вопросов практически любого академика-теоретика.
>Большинство химиков-исследователей уезжают. Поэтому кажется что остаются одни операторы.
Я не спорю, что на западе есть несколько реально продвинутых исследователей. Часто это те самые эмигранты.
>Он же не говорил что натрием круто сушить. Он лишь сказал мол им МОЖНО сушить.
Можно овсянкой сушить, кукурузной крупой. Есть дохуя вещей, которые обладают большой поверхностью и способны ненулевое кол-во воды убрать из спирта. Другое дело, что осушение натрием - очень неэффективный способ, и его "знакомый как-то раз перегнал изопропанол над натрием" еще и долбоеб потому, что не проверял кол-во воды после "осушения" - а зачем ты тогда вообще делал осушение по непроверенному методу?
Горит у меня конкретно жопа с того, что я люблю химию, а она загнивает, с одной стороны превращаясь в распил бюджета и примитивные прикладные области, а с другой стороны опять же распил, но уже намного более жирных бюджетов, и такая же толпа блондинок, которые идут учиться в институт, чтобы работать где-то в лабе аналитиком до конца своих дней за неплохую ЗП.
На фоне этого всего загнивает хим теория, которая начинает ориентироваться именно на таких долбоебов. В итоге я читаю какую-нибудь очередную популярную книгу, и нахожу там снова и снова очень скудную информацию, хотя книга и будет называться "продвинутое исчерпывающее расширенное руководство по применению пипеток". Доходит до смешного: некоторые книги выпускаются, как рекламные путеводители по продукции sigma-aldrich, merck, macherey-nagel, и прочих, при этом сам автор явно об этому не говорит.
Огромное кол-во интересных методов разработано в частных фирмах, но не применяются внутри из-за коммерческой неэффективности, при этом и не публикуются для пополнения общей копилки - вот это еще одна печаль.
>Сейчас бы проводить ИССЛЕДОВАНИЯ в области очистки веществ, когда все уже до тебя там веками проштудировано.
>Всем страждущим по этой теме советую гуглить Purification of Laboratory Chemicals последних изданий.
У меня есть последние четыре издания этой книги. Многие описания довольно скудны, сам автор книги не понимает, что происходит в описываемых им методах. Что не удивительно, поскольку методов очистки описано реально дохуя.
>>48596
>На любом химфаке тебя так выебут теор. химией и термодинамикой, что ты сможешь ночью все способы предсказания растворимости от простых до сложных рассказать
Знать много мусора и уметь предсказывать растворимость - это разные навыки. Они там в институтах часто совсем отрываются от реальности. Я общаюсь с действующими и вполне прошаренными химиками, в основном они работают в рашке, некоторые уехали. Вполне возможно, что никто из них не уделяет много времени вопросам растворимости, потому не накопили солидного багажа по теме.
То, что преподается в институтах - это хуета, я могу завалить с пары вопросов практически любого академика-теоретика.
>Большинство химиков-исследователей уезжают. Поэтому кажется что остаются одни операторы.
Я не спорю, что на западе есть несколько реально продвинутых исследователей. Часто это те самые эмигранты.
>Он же не говорил что натрием круто сушить. Он лишь сказал мол им МОЖНО сушить.
Можно овсянкой сушить, кукурузной крупой. Есть дохуя вещей, которые обладают большой поверхностью и способны ненулевое кол-во воды убрать из спирта. Другое дело, что осушение натрием - очень неэффективный способ, и его "знакомый как-то раз перегнал изопропанол над натрием" еще и долбоеб потому, что не проверял кол-во воды после "осушения" - а зачем ты тогда вообще делал осушение по непроверенному методу?
Горит у меня конкретно жопа с того, что я люблю химию, а она загнивает, с одной стороны превращаясь в распил бюджета и примитивные прикладные области, а с другой стороны опять же распил, но уже намного более жирных бюджетов, и такая же толпа блондинок, которые идут учиться в институт, чтобы работать где-то в лабе аналитиком до конца своих дней за неплохую ЗП.
На фоне этого всего загнивает хим теория, которая начинает ориентироваться именно на таких долбоебов. В итоге я читаю какую-нибудь очередную популярную книгу, и нахожу там снова и снова очень скудную информацию, хотя книга и будет называться "продвинутое исчерпывающее расширенное руководство по применению пипеток". Доходит до смешного: некоторые книги выпускаются, как рекламные путеводители по продукции sigma-aldrich, merck, macherey-nagel, и прочих, при этом сам автор явно об этому не говорит.
Огромное кол-во интересных методов разработано в частных фирмах, но не применяются внутри из-за коммерческой неэффективности, при этом и не публикуются для пополнения общей копилки - вот это еще одна печаль.
>Сейчас бы проводить ИССЛЕДОВАНИЯ в области очистки веществ, когда все уже до тебя там веками проштудировано.
>Всем страждущим по этой теме советую гуглить Purification of Laboratory Chemicals последних изданий.
У меня есть последние четыре издания этой книги. Многие описания довольно скудны, сам автор книги не понимает, что происходит в описываемых им методах. Что не удивительно, поскольку методов очистки описано реально дохуя.
>>48596
>На любом химфаке тебя так выебут теор. химией и термодинамикой, что ты сможешь ночью все способы предсказания растворимости от простых до сложных рассказать
Знать много мусора и уметь предсказывать растворимость - это разные навыки. Они там в институтах часто совсем отрываются от реальности. Я общаюсь с действующими и вполне прошаренными химиками, в основном они работают в рашке, некоторые уехали. Вполне возможно, что никто из них не уделяет много времени вопросам растворимости, потому не накопили солидного багажа по теме.
То, что преподается в институтах - это хуета, я могу завалить с пары вопросов практически любого академика-теоретика.
>Большинство химиков-исследователей уезжают. Поэтому кажется что остаются одни операторы.
Я не спорю, что на западе есть несколько реально продвинутых исследователей. Часто это те самые эмигранты.
>Он же не говорил что натрием круто сушить. Он лишь сказал мол им МОЖНО сушить.
Можно овсянкой сушить, кукурузной крупой. Есть дохуя вещей, которые обладают большой поверхностью и способны ненулевое кол-во воды убрать из спирта. Другое дело, что осушение натрием - очень неэффективный способ, и его "знакомый как-то раз перегнал изопропанол над натрием" еще и долбоеб потому, что не проверял кол-во воды после "осушения" - а зачем ты тогда вообще делал осушение по непроверенному методу?
Горит у меня конкретно жопа с того, что я люблю химию, а она загнивает, с одной стороны превращаясь в распил бюджета и примитивные прикладные области, а с другой стороны опять же распил, но уже намного более жирных бюджетов, и такая же толпа блондинок, которые идут учиться в институт, чтобы работать где-то в лабе аналитиком до конца своих дней за неплохую ЗП.
На фоне этого всего загнивает хим теория, которая начинает ориентироваться именно на таких долбоебов. В итоге я читаю какую-нибудь очередную популярную книгу, и нахожу там снова и снова очень скудную информацию, хотя книга и будет называться "продвинутое исчерпывающее расширенное руководство по применению пипеток". Доходит до смешного: некоторые книги выпускаются, как рекламные путеводители по продукции sigma-aldrich, merck, macherey-nagel, и прочих, при этом сам автор явно об этому не говорит.
Огромное кол-во интересных методов разработано в частных фирмах, но не применяются внутри из-за коммерческой неэффективности, при этом и не публикуются для пополнения общей копилки - вот это еще одна печаль.
Тру.
Помню лет десять назад, продемонстрировал электролиз NaOH с выделением натрия, который ПОИДЕЕ невозможен, учитель мне банально не верил до того момента и говорил что это полный бред. А может я что-то путаю, если да - сорян, химия не моя специальность, изучаю как хобби.
Посоветуй годной литры по практикум химии.
И, кстати, про обучение в химфаке не соглашусь. Смотрел лекции одного преподавателя, он старается излагать теорию совмещая с практикой. Он сам говорил, что если не уметь представлять теор. задания на практике, то это бессмысленно, и практикум по химии это важнейшая часть химии.
>продемонстрировал электролиз NaOH с выделением натрия, который ПОИДЕЕ невозможен, учитель мне банально не верил до того момента и говорил что это полный бред
https://en.wikipedia.org/wiki/Castner_process
>>48713
>Он сам говорил, что если не уметь представлять теор. задания на практике, то это бессмысленно, и практикум по химии это важнейшая часть химии.
Опять неправильный фокус. Химик должен представлять реакцию перед тем, как ее сделать, чтобы предугадать проблемы и пути решения. А твой мудак-преподаватель учит представлять себе какую-то хуету. Большая часть техпроцесса - это подготовка реагентов и выделение продуктов в нужной форме, а сама реакция разрабатывается частично наугад и частично по каким-то эмпирическим догадкам. В итоге теории остается роль инструмента, олблегчающего задачу, но не заменяющего практического решения этой задачи.
>Посоветуй годной литры по практикум химии.
Рассказы о практической химии - это и есть теоретическая химия. Современные авторы настолько охуели, что пишут книги про свои бредни по мотивам химии. Ты понимаешь, что всего лет 50-100 назад книги по химии писали реальные химики, которые описываемые реакции делали?
Это я в том числе про растворимость пишу, потому что абсолютно невыносимо читать и слушать тот бред, которые современные авторы высирают по теме - их в псих стационаре нужно изолировать, они потеряли связь с реальностью и не отдают отчет о своих действиях.
>>48718
>Ни разу не было чего-то интересного
Здесь пишут обычно либо опытные химики с мета-анализами житухи, либо долбоебы-школьники, которым нужно домашку решить. Что тебе интересного написать?
И зачем ты мне это скинул?
Я прекрасно понимаю процесс, но меня удивил тот факт, что даже учителя не до конца знают таких вещей.
Охуенно объяснил блять.
Тогда поясни почему у оксида бора и у оксида углерода не атомная решетка.
>оксида бора
Атомная
>оксида углерода
У углерода можно предположить строение аналогичное SiO2. Но тут чисто энергетический выбор формы. Связь C=O прочнее двух связей С-O, а связь Si=O менее прочная чем две связи Si-O
Поэтому один в молекулах, а второй атомная решетка (которая блять трехмерный полимер считай)
>атомная
??У него же всего три валентных электрона, он не сможет создать упорядоченную трехмерную структуру
 135 Кб, 670x721
135 Кб, 670x721Даже на википедии картинка есть
Ага, ЭО Al и Be одинаковые и ЭО Si и Fe одинаковые:
BeO: ЭО (Be) = 1.5, ЭО (О) = 3.5, ΔЭО = 2.0, связь Be-O - ИС
Al2O3: ЭО (Al) = 1.5, ЭО (О) = 3.5, ΔЭО = 2.0, связь Al-O - ИС
Fe2O3: ЭО (Fe) = 1.8, ЭО (О) = 3.5, ΔЭО =1.7, связь Fe-O - ИС/КПС
SiO2: ЭО(Si) = 1.8, ЭО (О) = 3.5, ΔЭО = 1.7, связь Si-O - ИС/КПС
однако почему-то BeO и Fe2O3 имеют ионную кристаллическую решетку, а Al2O3 и SiO2 - атомную.
И это уже не говоря о том,почему алмаз и графит оба имеют атомную кристаллическую решетку, когда в алмазе все связи ковалентные неполярные (КНС), т.е. это как бы одна гигантская молекула, а в графите - в пределах одного слоя вся связи КНС, а между слоями вандерваальсовы связи (ВДВС), т.е. каждый слой - это гигантская молекула и этих молекул множество, почему это не атомно-молекулярная или молекулярная решетка?
А там не сильно избыточно? Мне ж это еще прочитать надо успеть, плюс задачи порешать
за два года - норм. Читать все необязательно. сравнивай с тем, что от тебя требуют на всеросе. однако если хочешь межнар, тот эти учебники должны отлетать от тебя как от зубов.
В 10 классе же в основном углеводороды попадаются, если я не ошибаюсь. Их пожалуй пройду, а остальное к 11 посмотрим.
И ещё вопросик, что важнее: читать учебники, или прорешивать прошлые задачи прошлых лет и по ним стараться теорию учить?
 23 Кб, 604x260
23 Кб, 604x260>BeO и Fe2O3 имеют ионную кристаллическую решетку
Кто ж тебе такое сказал... BeO изоэлектронен алмазу например, что ожидается как бы.
Знаешь, в чем проблема, ты пытаешься поделить все связи на 4 группы. Учитывая, что все связи имеют одну природу, это безуспешное занятие. Даже ебучие водородные связи, можно рассмотреть как химическую связь.
Кстати, посмотри на пик.
Если ты хочешь подробных объяснений, то проще сказать тебе какие книги по теоретической неорганической химии лучше прочитать. Ибо мне лениво столько инфы писать.
>В 10 классе же в основном углеводороды попадаются, если я не ошибаюсь.
Во втором туре общие задания. Поэтому нет. Там вполне себе серьезные задачи по орге.
>что важнее
Нельзя выделить что-то конкретное. Надо и решать и читать. Я в своё время прорешал за 20 лет всерос + мендель, у меня задачи кончились в 11-ом классе
>Если ты хочешь подробных объяснений, то проще сказать тебе какие книги по теоретической неорганической химии лучше прочитать.
Ок, давай лит-ры.
Сначала надо смазать первым томиком Неорганической химии третьякова.
Потом Неорганическая химия Хьюи
И еще можно Основы неорганической химии Коттон, Уилкинсон
>>48596
>На любом химфаке тебя так выебут теор. химией и термодинамикой, что ты сможешь ночью все способы предсказания растворимости от простых до сложных рассказать
завалить можно кого угодно и чем угодно. Всегда найдётся тот, кто умнее тебя в чём-то. Вопрос в практическом применении своих знаний
так получилось (я так вижу), что химики сами даже не пытаются как-то разрулить свои проблемы. Я хоть и физтех по образованию, но так получилось, что много занимаемся химией. Но меня всю жизнь учили: что-то не нравится – иди и сделай лучше
А ведь я никогда не задумывался об обратимости этой реакции и том, что у них близкие pKa. Вот только почему метанол сушат над магнием?
 506 Кб, 893x980
506 Кб, 893x980>>продемонстрировал электролиз NaOH с выделением натрия
>А не так ли впервые выделили натрий?
Пикрил.
>>48794
>А ведь я никогда не задумывался об обратимости этой реакции и том, что у них близкие pKa. Вот только почему метанол сушат над магнием?
>Вот только почему метанол сушат над магнием?
Вот, подучи химию еще немножко, и мозг совсем отомрет. Будешь биороботом, рассказывающим определения по памяти и вычисляющим молярные соотношения.
Метанол прекрасно сушится магнием по той же формуле, что и для натрия.
Ну ты прям комплимент мне сделал - я-то и не подумал, что низкое качество скана может кому-то помешать читать. К сожалению, книгу 1913 года не так просто найти в хорошем качестве.
На пикриле была история получения щелочных металлов, которая начиналась с калия, и постепенно переросла в натрий, более удобный по ряду факторов, и при этом не отличающийся по технологии производства.
> я-то и не подумал, что низкое качество скана может кому-то помешать читать.
ох, особенно когда ты читаешь четырех томник марча.
> К сожалению, книгу 1913 года не так просто найти в хорошем качестве.
а собсна, зачем ее находить?
к чему это сообщение вообще
 35 Кб, 640x480
35 Кб, 640x480Хочу провести эксперименты с прямым топливным элементом без использования платины в катализаторе. Чем можно предварительно раскуриться?
мимо из радиача
>Есть ли какие-нибудь гайды или литература по теме разработки аналитических методик?
Конечно есть. Половина химии - это аналитика.
>>48864
> К сожалению, книгу 1913 года не так просто найти в хорошем качестве.
а собсна, зачем ее находить?
>к чему это сообщение вообще
Это книга, написанная из вторых рук, где первыми были люди, непосредственно участвовавшие в разработке технологий производства щелочных металлов в конце 19-го века. 99% современных авторов, пишущих про щелочные металлы, никогда их не получали самостоятельно.
>>48829
>Да ты же уходишь от ответа. Что, сам не знаешь, светило?
Сообщение было 24 сентября, сейчас - 1 октября. Никто не знает? Хорошо, я отвечу: магния гидроксид нерастворим.
>99% современных авторов, пишущих про щелочные металлы, никогда их не получали самостоятельно.
Думаю что ты преувеличиваешь. В наше время с помощью интернета это любой школьник может сделать (я)
Из твоего вопроса ничего не ясно. Пиши конкретно: какой состав, какой метод, какой прибор.
УФ-видимая спектрофотометрия. Аспирин, аскорбинка, рутин, димедрол, глюконат кальция. Прибор Шимадзу 1800.
Мне бы просто понять принципы: как можно добиться разделения пиков, с какими параметрами работать.
Скажите, тут ведь ошибка? они утверждают что приготовленный по этой формуле раствор будет иметь плотность 1,096. Но это плотность 15%-го раствора, а чтобы приготовить 15%-ный нужно 300 умножать на 15 а не на 10 (1-ый пикрил).
И еще вопрос: например концентрация 10% раствора серной кислоты при нормальных условиях будет со временем увеличиваться а не уменьшаться? из-за испарения воды?
Смотри у тебя 15 грамм в 100 мл.
100 мл весят 109,5 г поэтому это где-то 13%
Но у 10% раствора, плотность и правда 1,066, поэтому там опечатка.
Меня больше другое заботит. Какого хрена, такие убогие методики для всяких почвоведов? Я понимаю, что преподы считают почвоведов за животных, которые не должны знать химию, поэтому дают им особые "простые" формулы и т.д. бери, смотри в табличку и подставляй мол.
Но это же полная параша. Можно за месяц два, научить химии и давать методики в нормальном виде. Это же просто какой-то пиздец.
Конкретно эта методика для агрометеорологов. И там ещё не раз повторяется что нужно именно 1,096 плотность и 10% раствор.
 33 Кб, 538x468
33 Кб, 538x468Гугл как бы намекает.
>И еще вопрос: например концентрация 10% раствора серной кислоты при нормальных условиях будет со временем увеличиваться а не уменьшаться? из-за испарения воды?
и до каких пор она будет увеличиваться?
проведи эксперимент, проверь, где стабилизируется
Действительно, максимумы поглощения в смеси могут перекрываться, кроме того они и без того достаточно широкие. Если не перекрываются - все просто, в другом случае чаще всего количественный анализ не провести,или может расчетный метод Фирордта лол . Нужно искать методики выделения или разделения компонентов, затем, определять их как обычно с калибровкой по внешнему стандарту. Возможно, есть методы определения через получение комплексов конкретного вещества из смеси с какими-либо металлами с последующим определением в видимом диапазоне. Но это все равно страшная дичь, т.к. для смесей используют ВЭЖХ-УФ без всего этого цирка.
> И там ещё не раз повторяется что нужно именно 1,096 плотность и 10% раствор.
Плотность ещё и от температуры зависит, ведь при нагревании жидкости расширяются.
Меня как раз-таки интересует возможность количественно определить хотя бы несколько из этих веществ в одном растворе. Ну там, рН поварьировать, комплексы получить
ну да, легче узнать влажность, температуру и давление, чем просто дать раствору простоять.
Где там написано про цветные реакции нитрогруппы? Искал в оглавлении, не нашёл
Кольман и Ленинджер, особенно Ленинджер.
Лучше брать несколько книг и смотреть сразу во всех.
Конкретно смотри теоретическую химию хьюи, неорганическую химию под ред. Третьякова. А хай левел это Гринвуд и чтение статей.
Вообще, на сайте химфака МГУ есть списки учебной литературы.
Ну можно это конкретно для меня сложно... Я запутался мне нужна помощь.
 231 Кб, 512x443
231 Кб, 512x443Химия - это логика. Примерно как та же математика. Всё должно сходиться, хоть те же хим. уравнения реакции. Если выучить основу, можно продвигаться глубже.
Еcли есть конкретные вопросы/траблы - обращайся.
У меня в школе были проблемы с математикой, но вот химия мне сейчас интересна и я не знаю с чего начать и намного ли она сложна математики? Какую годноту я смогу пилить имея математические знания?
 337 Кб, 640x614
337 Кб, 640x614> Какую годноту я смогу пилить имея математические знания?
Ты сможешь вкатываться в естественные науки. Вопрос встречный - с какой целью ты хочешь вкатиться в химию?
Познать мир и узнать больше о строении материи - любой начальный учебник и читай про модельки Бора итд, пока не дойдёшь до орбиталей, квантов и прочей хуйни.
Хочешь узнать как оно в лабораториях, что можно сделать из говна и палок - https://www.youtube.com/user/TheRedNile/videos
> намного ли она сложна математики
Нет, лично я так не считаю, но дроча будет очень много, особенно в органической химии.
Метиловый фиолетовый и оранжевый - самое прикольное и цветное. Из органики офк.
На аноргане варили всякие выёбистые комплексы всех цветов и кристальных структур. Если интересно, могу больше рассказать.
А что-нибудь фениловое... Ну или прикольное. Почему нельзя отсоединять молекулы и тд. Когда химия из станет точной наукой?
Фениловое ему подавай...... как насчёт индиго и фенолфталеина?
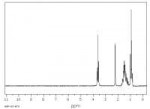
Есть проба, в которой находится 3 вещества (мне уже известных). Хотелось бы, чтобы опытный человек объяснил, как вообще это говно работает, почему некоторые пики совпадают, почему они именно так, и как из ЯМР узнать, какое это именно вещество (уже всё проинтегрировано и нормировано).
А насчёт логики.... В книгах всё логично, а в лабе можно и бибу пососать, а потом сидеть и ломать голову, почему.
То есть, есть 1Н-ЯМР этой пробы из 3 веществ и надо по пикам узнать, где что и какое строение у каждого из этих веществ.
Спектр ЯМР смеси веществ - это "наложенные" друг на друга спектры отдельных компонентов смеси (при условии, что эти вещества не реагируют друг с другом, не образуют комплексов, водородных связей и т.п).
Именно поэтому для подтверждения/определения структуры соединения спектры смесей не используются, т.к. невозможно однозначно определить, какой сигнал к какой из молекул относится.
>спектры смесей не используются, т.к. невозможно однозначно определить, какой сигнал к какой из молекул относится.
Порой нет выбора, и пиздец(
Учебник Глинки мне не понравился. Не воспринимаю совсем. Ещё в нём совершенно лишние исторические отсылки. Взял учебник для школьников.
мимо электрик-заочник
Если вещества уже известны, то тебе достаточно сопоставить спектр с литературными данными. На рутрекере есть база спектров от Sigma Aldrich. Ещё можно посмотреть SDBS, но там только спектры распространенных веществ.
зачем тебе использовать ямр анализ, если вещества уже известны?
анализ используют для получения спектра по которому потом структуру предполагают. то есть при получении нового вещества.
смеси анализировать это такое себе развлечение.
особенно многокомпонентные, где еще растворитель может прореагировать с чем-нибудь. опять же там будет наложений куча.
и да гипотетически ты сможешь предположить, что вот эти три вещества дают вот эту группу пиков. но на практике так не делается.
сначала вилкой чистят, разделяя на компоненты, а потом уже покомпонентно анализируют.
мимо ничего не знаю ни о химии ни о ямр, просто использую логику
У каждого протона в каждой молекуле весьма уникальный химсдвиг. В случае, если эти сигналы накладываются задача усложняется, но можно рассудить логически, кроме того есть и методы ямр, позволяющие решить отделить сигналы разных веществ.
А, т.е. в его состав входит не вода, а компоненты, входящие в состав воды, и зафигаченные в него из этой самой воды?
Как это влияет на его свойства? В частности на микротвёрдость?
Интересуюсь потому что эту хуету в составе зубной пасты используют, интересно твёрже ли оно эмали.
Обычный диоксид кремния сильно твёрже.
>По ЯМР самое простое.
я вообще всегда думал, что соотношение известных компонентов смеси легче, а главное дешевле, определить хроматографически.
Кажется, мне говорили, что спектр просто так не предскажешь.
>>51077
На курсах нам говорили, что у этого метода не очень высокая точность, и он плохо подходит для подобного.
>>50972
>что вот эти три вещества дают вот эту группу пиков. но на практике так не делается.
Почему же? В бытность свою дипломником я различал конформеры полученного октаэдрического комплекса рутения.
Не помню, какие пределы у хроматографии, но у современного количественного метода ямр это 1,5%. А это очень высокая точность.
Все относительно. Оценочный анализ по ямр с внешним стандартом можно получить за 5 минут вместе с пробоподготовкой. Некоторые вон, по ик смеси определяют.
Похоже, я неправильно понял лектора. Спасибо.
>и мои родители не заканчивали выссшие учебные заведения, все были крестьянами.
На тебя-то это как повлияло? Просто отгораживайся/избалвяйся от информационного шума/информационного мусора/говна/звукового загрязнения и прочих раздражителей и занимайся чем хочешь.
Ты же не думаешь что то что прошлые поколения твои жили как тупни как-то отпечаталось у тебя с рождения?
Ну может в мозгах нету нужны нейронов просто и не хватит смекалки продвигаться в этой науки.
В теории - да. На практие - в смеси двух пикрилов ты не поймешь, где чей метил с помощью обычного протонника.
>>51103
>Кажется, мне говорили, что спектр просто так не предскажешь.
Точные хим. сдвиги - да, предсказать сложно. А мультиплетность, сигналы с с одинаковым J и интегралы программы предсказывает неплохо. Для малых молекул, по крайней мере.
>На курсах нам говорили, что у этого метода не очень высокая точность, и он плохо подходит для подобного.
С точностью все нормально, проблемы с чувствительностью. Но и она с применением все более сильных полей улучшается.
>>51095
После GC/LC-MS образец будет проебан, а после ЯМР - нет.
А еще при использовании ЯМР можно поставить реакцию прямо в ампуле и смотреть ее протекание в режиме он-лайн. А еще в ряде случаев пробоподготовка для ЯМР значительно проще.
>В теории - да. На практие - в смеси двух пикрилов ты не поймешь, где чей метил с помощью обычного протонника.
На практике как раз понятно чей конкретно это метил. Это видно по интегральной интенсивности относительно других сигналов.
Иногда они накладываются.
Даже если там "смесь разных метилов разных веществ" можно проинтегрировав другие протоны этих веществ с заведомо известным химсдвигом, определить их соотношение. Кроме того, для подавляющего большинства из всей когда-либо синтезированной органики найти описание протонника не составляет труда, и вот предсказатели в расчетах зачастую очень близки к реальным значениям.
По картинкам можно зацепиться разве что по dosy?)
Ага. Можешь прям так найти, Вася Пупкин из верхнихзалупок
Просто берёшь и учишь.
Старайся не учить а понимать почему так или так. Есть две дисциплины, которые помогут тебе в понимании химии: Термодинамика и Строение молекул. В комбинации, многие вещи будут логично вытекать из простых предположений.
Тебе должно быть интересно и ты должен этого хотеть. А не учить потому что иначе двойку поставят и мамка отпиздит.
Если так то лучше учи как отпиздить мамку.
Вряд ли тут это.
Скорее нет знаний прошлого уровня чтобы понимать следующий, нет базы. Ну или неинтересно.
Просмотром сериалов, аниме, научпоп и просто видосиков на ютубе.
Бамп. Не, аноны, я понимаю что за это можно присесть и прочее прочее. Это просто интерес. Ибо в описании говорится, что это достаточно легко сделать, хотя соединение довольно сложное
 63 Кб, 200x200
63 Кб, 200x200> В России препарат внесён как психотропное вещество в список I (наркотические средства, психотропные вещества и их прекурсоры, оборот которых в Российской Федерации запрещён в соответствии с законодательством Российской Федерации и международными договорами Российской Федерации).
Эта страна случаем не называется манямирок?
>А я живу в стране где можно да. Понятно?
Если можно, то много кто этим занимается, найди такого и попроси, он тебе по фану покажет.
Вой, какой ты нервный, нарколыга, у тебя ломка похоже, прими что-нибудь. Например риталин.
Ой, у тебя же нету, сорри, я забыл.
Еблан.
Прошу помощи у опытных электрохимиков. Провожу замеры в трехэлектродной ячейке с хлорсеребряным электродом сравнения. Очень нужны таблицы с окнами стабильности потенциала электролитов.
 3 Кб, 207x175
3 Кб, 207x175Я тебе дал ответ. Ты заебешься собирать тропановый цикл из молекулы новокаина. Это как складывать слово "счастье" из букв "Ж", "О", "П" и "А". Целесообразнее начать синтез с 2,3-дизамещенного тропана.
Так риталин можно сделать из гидропропана и пироцитама?
 3 Кб, 207x175
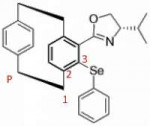
3 Кб, 207x175Навскидку, если не лезть в учебники, у меня получилось R (pR).
Выбираем пилотный атом как на пике, строим дорожку по старшинству в плоскости хиральности. Селен старше всех. Смотрим из пилотного на плоскость, 123 закручены по часовой, значит pR.
Но это навскидку.
А разве плоскость с пилотным атомом будет не "под" плоскостью с селеном, судя по клиновидным связям?
 7 Кб, 635x103
7 Кб, 635x103Если у кислоты n форм, то можно получить формулу распределения для каждой.
Выводится эта формула простейшим образом. Для карбоната например, получится
K1K2/([H]2+[H]K1+K1K2)
Так же когда-то давно в школе, я придумал универсальный способ решения любой задачи на равновесия, но мне лень его описывать.
>Gidrated Silica чем-то отличается от обычного диоксида кремния/песка?
Бамп.
Так что вообще H2SiO3 делает в зубной пасте и какая у него микротвёрдость?
Чёт почитал мельком и выходит это совсем не песок уже, а кислота.. Она хоть твёрдая при н.у. В виде чего она при н.у.?
А хули тогда никто так не делает чтоб бабки с экономить? Или ты самый умный хуйлуша.
Мне нужен рит я проживаю в стране где он разрешен просто денег нету на постоянные его покупки. Я тян.
Запрещенное только выгоднее самому делать. Если что-то легальное, то цена ниже чем цена для варки. Это блять очевидно.
Цены сам посмотри придурок. Если ты не разбираешься в химии то перестать заниматся словесным онанизмом и крючкотворством.
>Если ты не разбираешься в химии то перестать заниматся словесным онанизмом и крючкотворством
Тов. майор, вы слишком сильно пытаетесь выполнить план.
Долбоеб, всё гуглится
Я гуглила и нечего найти не смогла. Если ты рзабираешся в вопросе и готов мне объяснить то давай свои контакты.
В промышленности описана схема синтеза метилфенидата из 2-хлорпиридина и цианистого бензила.
На выходе получается метиловый эфир α-фенил-α-(пиридил-2) уксусной кислоты,
который восстанавливается над платиновым катализатором.
https://www.youtube.com/watch?v=P3JeT_PBFTU
Ты придурорк блять с вики мне написал, я девушка, а не химик. Помогай и я тебе отблагодарю или вали к черту урод.
>цистеиновая
Блядь, шмара риталиновая, конечно же.
Хотя всем похуй что чем ты порешься там, никто особо и не читает.
Не уж-то ты думаешь что есть методы синтеза оптимальнее промышленных?
Курц Реутов
Клейдн.
Смотри еще на ютубе лекции по органике МГУ, есть базовый уровень, и уровень продвинутый.
>Хули толку читать учебник, если нихуя в нем не понимаешь
Там же с основ начинают. (Пропусти в Курце главы с физхой и квантами).
Ну и смотри лекции
 56 Кб, 1024x526
56 Кб, 1024x526Слышь, растрёпа, гугли сама своё сраное ширево
или иди горбатится и вагоны разгружать за ничтожную дозу.
Пиздатые танкеры в Афгане, без таких как ты, за дозу какса, сами себя не загрузят.
 566 Кб, 890x514
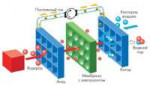
566 Кб, 890x514Речь пойдет о водородных топливных элементах, чтобы было примерно понятно о чем речь, как в этом видео https://www.youtube.com/watch?v=CloiW8fLLP0
Суть - собрать подобный элемент в гараже занедорого. Гугл пестрит статьями и видео о простейшем опыте с электролизом, но никакой конкретики нарыть не смог, что за секретные документы то епт.
Ни расчетов, ни характеристик, ни-ху-я. Только смутные упоминания, что как катализатор можно использовать не только платину, но и никель и нержавейку с высоким его содержанием.
Нашел пикчу, понятнее не стало. Система негерметичная я так понимаю, для выхода продукта реакции.
Как рассчитать размеры, объем подаваемого газа, при условии кислорода из атмосферы, а не баллона, выход энергии в конце концов.
Насчет мембраны, вычитал что она не особо то и нужна, если выдержать расстояние между анодом и катодом. Или влияет на эффективность?
Насколько важна толщина пластин, если они всего лишь служат катализатором и единственное, что по идее важно - их площадь.
Не хотелось бы методом тыка собрать херню размером с телевизор и получить энергии на светодиод.
Из твоего видео, очевидно, что там используется два катализатра - катализатор анода и катализатор катода.
>на катализаторе, возле анода, молекулярный водород - диссоциирует, и теряет электроны.
Вот диссоциацию молекулярного водорода и гугли.
И на тебе, заодно, вот такое видео: https://www.youtube.com/watch?v=ksdxeS0MXRg
Далее,
>катионы водорода, проводятся через мембрану, к катоду.
>А электроны отдаются во внешнюю цепь...
Какие катионы? Протоны. Через какую мембрану? Протоннообменную, очевидно же. Вот её и гугли.
Затем,
>на катализаторе катода, молекулы кислорода соединяются с электроном и пришедшим протоном,
>которые образует воду, которая является единственным продуктом реакции.
Что здесь происходит? А вместо того, чтобы протоны реагировали с электронами, протекает реакция:
O2 + 4e- -> 2O2-
Этот процесс называется активация молекулярного кислорода. Вот катализатор для него и гугли.
А после активации уже, идёт реакция между ионами: 4H+ + 2O2- -> 2H2O
>Не хотелось бы методом тыка собрать херню размером с телевизор и получить энергии на светодиод.
Выхлоп зависит от громоздкости этой твоей конструкции.
Ты же видишь, как плотно упакованы в батарею топливные ячейки на видео?..
>Суть - собрать подобный элемент в гараже занедорого.
Не в гараже, конечно, но вот: https://www.youtube.com/watch?v=7PvPz0TuyZ8
Как ты собрался-то хранить легко диффундирующий водород, в гараже своём?
Помоги найти книжку. Там, кароч, такой справочник, где есть данные по химическим сдвигам многих веществ, примеры спектров разных растворителей и примесей в ЯМР. Подробно показаны разные классы органических соединений и т.д. По моему там и ИК, и УФ, и МС есть.
Памагити, оч нужно(
На кой чёрт тебе книжки? Есть же спектральные базы данных. SDBS, NIST, до фига всего
Пиздуй в /un
В любом случае твой способ слишком сложен для обычного человека и если бы он был реален то сейчас бы толпы людей делали из новокоина. Ты лучше мой друг скажи вот что: реально ли сделать риталин?
Хотя, если там двойка перед углекислотой, то, наверное, разложение кристаллогидрата оксалата меди
CuC2O4•H2O -> Cu + H2O+ 2 CO2
Я ничего не понимаю, что мне следует делать чтоб понимать эту неведомую зверюшку именуемую химией? Может вообще никакой химии как такой не существует, вить мы не видим процесс соединения молекул и это лишь набор суеверий?
 27 Кб, 620x406
27 Кб, 620x406Чтобы понимать неведомую зверюшку, надо учиться. Ну или не надо. Миллиарды людей живут вообще ни хрена не понимая.
Процесс соединения молекул мы видим. Если хотим, конечно. Если не хотим, то достаточно сказать, что Менделеев придумал водку, а на остальное забить.
А как учиться, если математика тебе не дается, конечно с химией я её не пробывал, но полагаю результат будет такой же.
>как дристалин сделать
В большую пробирку помещают смесь 2,5 г фталевого ангидрида, 5 г фенола и 1 мл концентрированной серной кислоты. Смесь периодически перемешивая нагревают 1,5 час на глицериновой бане при 125 – 130 °С.
По окончании реакции еще горячую смесь выливают в
стакан с 50 мл горячей воды. Образовавшуюся суспензию осторожно кипятят, постоянно перемешивая стеклянной палочкой, до исчезновения запаха фенола.
контору не пали
Слушай друг, а эти вещества его производные легко найти? Просто у меня дефецит внимания и я не могу найти риталин. Можешь подсказать чего, наркотики я никогда не употребляла и не собираюсь.
А чё, его продают сильно дороже чем его составные части?
Женщина, желающая получить бесплатно то, что мужчины покупают, - достаточно распространенный типаж.
Ты про знания или риталин?
Саентач, помоги тупому студенту. Не могу написать реакцию п-толуидина и пропионовой кислоты. В задании указано написать реакции на холоду и при нагревании. Я понимаю, что одна из этих реакций это тупо ацилирование толуидина (скорее всего, на холоду). Но что тогда будет при нагревании? Все интернеты облазил. Заранее благодарен.
 14 Кб, 428x420
14 Кб, 428x420Ничего не мешает. Только у тебя структура будет не такая, и скрутить не сможешь.
Ацилирование как раз при нагревании (минус вода так как).
А на холоде... ты будешь смеяться над простотой ответа, так что я под спойлер запишу: аминосоль
Спасибо!
бромкетон-4, он же: 2-бром-4-метилпропиофенон.
По ссылке, что я тебе дал - получение 2-бром-4'-метилпропиофенона (Бк4) из 4-метилпропиофенона, с предварительным его синтезом.
Читай внимательно же.
Бро, чем отличается бром от броменкона-4? Да и ещё ты видел какая у автора видео аппаратура химическая. Да и ещё компоненты которые нужны для синтеза броменкона-4 стоят дорого и они запрещены. Сори если что то перепутал бывает.
То ли это моча троллит, то ли товарищ майор знатоков отлавливает. Я не верю, что бывают такие тупые люди. У меня просто в голове не укладывается, как умственно отсталый наркоман может залезть в /sci и день за днем нечленораздельно чего-то выпрашивать.
Блядь, точно. Не увидел HI в таблице.
 2 Кб, 189x40
2 Кб, 189x40А пикрил можешь помочь? Rb3 это сильное основание RbOH, а дальше как?
первые только поглощают, вторые поглощают и переизлучают.
Я вообще-то девушка давай с этого начнем и знания по химмии у меня нулевые. Цены прикинула так.
Да и вообще все эти шаги сложные без специально аппаратуры и какой смысл его синтезировать, если бк 4 можно купить за 6к? Ты об этом не подумал смотрю?
Ты не девушка, ты мудло неопределенного пола, но определенного уровня интеллекта. Съеби из саентача со своими нулевыми знаниями.
Окраска определяется координационным окружением иона Cr 3+. Ионы хрома больше, чем ионы алюминия, поэтому октаэдры из ионов O2- вокруг них искажаются. Энергия орбиталей хрома из-за этого тоже меняется и соответствует поглощению в ультрафиолетовой, фиолетовой и желто-зеленой областях спектра.
Но мне интересно и я готова учить с тобой вместе.
Вы думаете у вас получится? Просто лично я вообще не понимаю химию и для меня это ничего не говорит.
Тебе ссылку дали, там расписано получение 4-метилпропиофенона.
>>52131
>Бро, чем отличается бром от броменкона-4?
Бром - это галоген, как йод или хлор.
А броменкон-4 - я вообще ебу что это такое, похоже на бромкетон-4, но буквы у тебя другие.
>ты видел какая у автора видео аппаратура химическая.
>Да и ещё компоненты которые нужны для синтеза броменкона-4 стоят дорого и они запрещены.
Не хочешь получать бромкетон-4, купи и не еби мозги своим броменткайном и йодменконом.
Когда правильно сформулируешь название своего заветного соединения,
вот тогда и структурную формулу нагуглишь, и синтез его.
Что касается запрета компонентов, хуйня всё это...
Хлорид алюминия - это нашатырь, не запрещён.
дихлорэтан - из ацетилена можешь получить.
пропионилхлорида - из пропионовой кислоты получишь
толуол - получишь из бензола, бензол же - тримеризацией ацетилена.
Недавно 40 килограмм калифорния синтезировал для продажи на международный рынок.
Если не сложно скажи как максимально упростить процесс.
Тут и так всё просто. Вместо платины - никель попробуй, он тоже адсорбирует водород.
Бензилцианид... С толуола сначала получишь бензилхлорид, и с цианистым натрием он даст бензилцианид.
Цианистый натрий - из амида натрия можешь сделать, нагревая его с углём до 500-600°C, вот так: NaNH2 + C → NaCN + H2
Амид натрия, чтобы с металлическим натрием и гидридом натрия не работать - из оксида получишь:
Na2O+NH3 -> NaNH2+NaOH (Реакция оксида натрия с жидким аммиаком при температуре −50 °C)
Или так (800-900°C): Na2CO3 + C + NH3 → 2NaCN + 3H2O
Или же, через цианамид кальция (600-700°C): CaCN2 + C + Na2CO3 → CaCO3 + 2NaCN
2-хлорпиридин - получить можешь из пиридина, хлорируя пиридин при 0–5 °C, в присутствии хлорида палладия.
Пиридин же - синтезируешь самостоятельно, из ацетилена и синильной кислоты. И смотри не траванись её парами.
Да, ну и не забывай, что все цианиды просто нереально ядовиты, любой контакт с ними или их испарениями приведет к быстрой смерти. А без них в некоторых синтезах вообще никак.
Друг можно вопрос один.
А сколько нужно денег на аппаратуру ну колбы там и тд, вроде ещё нужна магнитная мешалка.
Ты же понимаешь, что он все это расписал с целью показать, что овчинка выделки не стоит? Пытаться собрать хим. лабораторию на коленке с нулевыми знаниями и стартовать чуть ли не с водорода, кислорода и углерода - сомнительная затея, даже не беря в расчет то, откуда ты эти расходники брать будешь.
Я готов вложить деньги ибо этот препарат мне нужен. Наверняка есть какой-то рецепт с помощью которого можно значительно удешевить производство, но его скрывают за сеиью печатями.
Не надо деньги.
Колбы из стекла отлей, оно плавится при 1800 цельсия,
а расплав сплава неодим-железо-бор, после отлива - намагнить электромагнитом типа "соленоид".
А их не легче купить? И еще один вопрос нельзя ли все уложить в одну две реакции миновать этот синтез с нуля? Жаль я химию не знаю...
 12 Кб, 241x173
12 Кб, 241x173На правах покумекать, есть ли нормальные способы получения подобных аминов, где R - Alk, с различной длиной хвостов?
Из-за того, что не один химик не подсказал мне вещество для удержания губки как можно дольше во влажном состоянии. Я нашёл сам свой депрессор и с вами ним не поделюсь.
Смотря из чего получать. Так-то и из диаминобензоилхлорида с реактивом гриньяра получится, с хреновым выходом.
Через вот такой большой катализатор:
CO2 + [+4H2 => CH4 + 2H2O => (-2H2O) => CH4 + O2 => C+2H2O =>
C на выход => электролиз 4H2O => 4H2 + 2O2 =>
4H2 в начало, O2 к метану, и ещё O2 - на выход] => C + O2↑
Я бы такой фигней не страдал, а получил фотосинтетически углевод и кислород. Углевод потом обуглил.
Если уж самогонный аппарат лень собрать, то ни о каких химических реакциях и речи быть не может. Плати барыгам.
А! Придумал. Нагрей в тазу аммиачную селитру. Тут уж либо ебанёт, либо нет. В любом случае будет весело.
Это медленно как и любой микробиологический синтез, а то что я написал - можно и разогреть.
Алсо, чтоб метан не жечь в кислороде, можно и так: CH4 → C + 2H2 (1000 градусов)
Или, если перегреть, то так: 2CH4 → C2H2 + 3H2 (1500 градусов); C2H2 -> 2C + H2 (2000 - 2200 С);
Синтез любого препарата - это тонкая химическая технология. Невообразимо сложная по сравнению с самогоноварением. Очистка природного сырья проще, но тоже не для рукожопых ленивых невежественных мамкиных наркоманов.
Что можно сделать, я написал: веселящий газ из селитры. Но думаю, у такого "химика" она сдетонирует. И товарищ майор уже придет сажать на бутылку за изготовление взрывчатых веществ.
Бро, а можешь ещё что-нибудь рассказать. На что похожа химия, на какой другой предмет? Она сложнее математики? Тоже хотел заняться ей, но не позволяет возможность...
>Это медленно
А я никуда не тороплюсь. В условиях вопроса ничего не говорилось про скорость. Зато это можно сделать в семнадцатом веке на даче в теплице, а не в трех реакторах.
Из тирозина в ретикулин,
бодяжишь блядь тупо салутаридин,
с него сразу можешь уже - тебаин
и чрез кодеин - варишь дезоморфин.
 582 Кб, 1024x721
582 Кб, 1024x721>На что похожа химия, на какой другой предмет? Она сложнее математики? Тоже хотел заняться ей, но не позволяет возможность...
Химия очень разная. Соединяет инженерное дело, физику и биологию.
Ну это слишком.
Он на воздухе горит и в воде взрывается. Его под слоем киросина хранят.
Сначала подумалось мне, что легче всего получить калий - из фекалий.
Но википедия говорит другое:
>Важное промышленное значение имеют и методы термохимического восстановления:
>Na+KOH -> NaOH+K (380-450C, в атмосфере азота)
>и восстановление из расплава хлорида калия карбидом кальция, алюминием или >кремнием.
Отсюда и пляши, со своими калийными удобрениями...
>Неужели уже нельзя изготовить кристалики.
Кому надо, тому можно. А кому нельзя, тому и не надо.
Скорее всего для того чтобы ты сам, в микроволновке,
нитровал бензальдегид - нитроэтаном в присутствии бутиламина.
Бензальдегид купишь, или из толуола сваришь: C7H8 + MnO2 + H2SO4 = C6H5CHO (65%, 40°C)
А нитроэтан недешёвый, я гляжу, поэтому получить можешь его - реакцией бромэтана с нитритом натрия в диметилформамиде.
Нитрит натрия, в лаборатории, делают так: 2NaOH+NO+NO2 -> 2NaNO2+H2O
А бромэтан - по реакции с бромоводорода с этиленом: CH2=CH2 + HBr -> CH3CH2Br
Бромоводород же, из бромистого калия можешь сразу сделать: 2KBr+H2SO4 -> 2HBr+K2SO4
А диметилформамид найдёшь сам, или же сварганишь реакцией муравьиной кислоты с диметиламином:
HCOOH + HN(CH3)2 → HCOOH∗HN(CH3)2 (40 C)
HCOOH ∗ HN(CH3)2 → (CH3)2NC(O)H + H2O (120 C)
Этилен не нужен. Можно непосредственно из этилового спирта в серной кислоте. И вообще, ДМФА и нитроэтан из двух разных схем синтеза, не путай человека, он и так дурак.
А есть еще схема из бензола, аллилхлорида и аммиака. Но с аллилхлоридом в микроволновке работать очень грустно. Обрыдаешься.
Короче, если чуваку хватит ума сделать мет из набора "юный химик" и ассортимента хозмага, упороться и не сдохнуть, можно его медалью награждать. Почище всякой олимпиады. Но тут явно не тот случай.
Нет таких условий. Любой неолух может посчитать термодинамику. При любой попытке разложить углекислоту будет получаться CO как прочнейшая из двухатомных молекул.
Ну или вызывать демона Максвелла, чтоб он ручками перебирал молекулы.
Из ком.доступного на Сигме. И что-то мне подсказывает, что такой бенз.хлорид нихера ты не купишь. Да и выходы будут околонулевые.
Диаминобензойную кислоту точно купишь.
А какая альтернатива? Ацилировать фенилендиамин? Ни фига не выйдет.
Ацилировать бензол, потом нитровать и восстанавливать? В принципе, в 2,3-положения оно пронитруется.
Из нитроанилина синтезировать по Ф-К нужный кетон, защитить, потом восстановить нитрогруппу?
>Из нитроанилина синтезировать по Ф-К нужный кетон
Дохлый номер. С нитросединениями Ф-К идет погано, а с аминами вовсе не идет, поскольку аминогруппа связывает кислоту Льюиса.
>а с аминами вовсе не идет, поскольку аминогруппа связывает кислоту Льюиса
Так защиту цепляй на неё сначала.
Амин защитить, разумеется. Нормально Ф-К пойдет, для того там и аминогруппа.
Не смешно.
>Где ваш энтузиазм?
Тратится на добывание еды.
Пидарахам только на еду должно хватать, а не на открытие собственных лабораторий.
Органическая химия, бюджет не большой, но и великие химики начинали из ничего. Будем производить фарму для и тд.
>Будем производить фарму
О, пили фейкопочту. Где планируешь производить? Не в Москве, надеюсь?
мимо провизор
Взял тебя на свой карандашик, сладкий.
Ты долбоеб? Речь идет в первую очередь о фарме, которая не запрещена законодательством России.
 781 Кб, 1138x997
781 Кб, 1138x997Ну да. Фарма же окупает стоимость лаборатории (10 млн минимум)
Тоже непонятно, что так потенциальный майор возбудился. Есть даже сообщества, не знаю как правильно на русском(хех, чепига ™), по взлому дорогостоящих фармпрепаратов. Гуглите, короче. Только дешево и безопасно вряд ли будет. Азеотропы у домашнего химика тяжко делятся, а рацематы так ваще.
Вторую часть чего ты не понял?
Есть такие анархисты https://habr.com/post/424923/ , которые хотят сами производить лекарства. Плюс обсуждение этой же темы https://science.d3.ru/mozhno-li-khaknut-lekarstvo-1666493 . Фарм компании имеют на этом бизнесе триллионы долларов и поднимают денег больше чем это можно сделать на наркотиках. Кроме этого они зарабатывают в легальном поле и лоббируют свои интересы в правительствах, в том числе подкупами. Нищие и бедные лишаются доступа к уже используемым препаратам из-за накруток в стоимости. https://lenta.ru/articles/2015/09/23/shkreli/ Ведётся и патентная война.
Вот там пытаются создавать эти лекарства сами, минуя компании. Я сомневаюсь в 100%-м успехе домашних лабораторий из-за чистоты исходников и технологий. Или для тебя незнакомо слово хиральность?
Ну у них вроде недавно кто-то откинулся.
Больше всего фармкомпании зарабатывают на "переизданиях" популярных старых лекарств с истекшим патентом.
Фарму, по окончанию патента может хоть кто делать, но я не стал бы говноварить нелегально, тем более с маленьким бюджетом.
>И что-то мне подсказывает, что такой бенз.хлорид нихера ты не купишь.
Купишь. Но влетит в копеечку.
>>52377
А на защиту кислота не сядет?
>>52154
>Слабая кислота?
HI - очень сильная кислота. А реакция вообще вряд ли что-то даст, поскольку тут нечему гидролизоваться.
>>52536
Тебе уже советовали фенолфталеин.
>Ищу единомышленников
>которыми можно открыть небольшую лабораторию >изчучать химию
>энтузиазм
@
@
@
>Будем производить фарму
Лол
Так мне нужно чтоб обяснили весь процесс допустим берем фенол и кладем его на печку на 40 мин потом туда обовляем ацетон.
 3,3 Мб, mp4,
3,3 Мб, mp4,1280x720, 0:27
В патенте на метод производства botulотоксина написано, что его можно осадить из фильтрованного бульона, в котором культивировался продуцент 20%-ным раствором поваренной соли. Значит ли это, что он осядет, а соль останется в бульоне или же она тоже осядет по какой-то причине? Видео для привлечения внимания.
Сам я парень простой, не химик. Botulотоксин нужен, чтобы иметь основания
списать с баланса склада годные консервы.
Сочувствующий так сказать.
 759 Кб, mp4,
759 Кб, mp4,380x446, 0:15
Сразу задам уж и второй вопрос: то, что в фильтрованном бульоне из-под культуры Clostriдиум botulинум удастся осадить соляным раствором будет безопасно хранить/переносить? Я имею в виду ингаляционный аспект. Botulотоксин не будет в осадке таким концентрированным, чтобы отравлять испарениями?
Бля, ебаная макаба. Надо использовать защитные группы, устойчивые к кислотам. Какое-нибудь кондовое говно типа бензильной или трифторацетиловой.
Наркоманы готовят некий "фен" буквально на корачки.
Не бузи котик.
А что это за вещество?
На твоей кухне есть перегонный куб с прямым холодильником, термостат и центрифуга? Если нет, то даже если ты синтезируешь риталин как таковой, отчистить его от других продуктов реакций, многие из которых будут ядовиты, у тебя точно не получится.
Эта затея по соотношению труда и результата подобна затее стать Нобелевским лауреатом, чтобы впечатлить одноклассницу.
Фен дома готовят профессиональные химики с лабораторным оборудованием, да и то это часто заканчивается плохо. А простые наркоманы, пытающиеся употреблять приготовленный собственноручно фен, живут очень недолго. Алсо, фен приготовить легче, потому что есть наработанные схемы и подробная методическая литература, гайды и мануалы, расчитанные на почти любой уровень подготовки, да и прекурсоры доступные. А чтобы организовать производство риталина, нужно смотреть соответствующий патент, знать техническую регламентацию, стандарты, творчески скорректировать путь в соответствии с непромышленными масштабами и возможностями, это очень непросто, для этого нужно обладать глубокими знаниями и надёжным оборудованием.
Самое главное ты забыл, как из этого бульона терапевтическую дозу получить. Хотя бы не летальную.
 3,7 Мб, webm,
3,7 Мб, webm,400x712, 0:21
Бампую бамп, родные, помогайте.
Была мысль изначально получить хотя бы метилкетон через нитрование 3-ацетиланилина с защитой во 2ое положение,но есть большие сомнения.
Я тебе скажу. что всё давно уже придумано и лежит в интернете. Просто тупые должны страдать.
В деньгах ограничен, так что рублей 700 могу скинуть
>Фенотропил
Тут посмотри про синтез фенотропила из 4-фенил-2-пирролидона: http://www.findpatent.ru/patent/266/2663899.html
и тут про синтез самого 4-фенил-2-пирролидона из З-карбоэтокси-4-фенил-2-пирролидона: http://www.findpatent.ru/patent/150/1502567.html
Та бля какая разница.
Нет, я прост не химик и для меня много неясного. Я не совсем представляю как от осаждения перейти к собственно добытию. То есть, осядет искомое вещество в виде осадка, допустим. А как я его со дна соберу, учитывая, что температура кипения у бульона выше, чем температура, при которой искомое вещество распадается? То есть, выпарить не удастся.
Думал, через фильтр какой процедить, но что-то не приходит в голову ничего, через что можно фильтровать жирный бульон.
А через что можно фильтровать мясной бульон?
Котик, скажи хотя бы что можно сделать, просто интересно.
 31 Кб, 215x196
31 Кб, 215x196проблема 1 в том, что радиусы если и даны, то по 1 для каждого элемента (внешний, либо общий - не знаю), а не понятно, какими являются все остальные, т. е. внутренние радиусы
проблема 2 в том, что нигде нет таблицы энергий каждого электрона/орбитали в атоме; например, на типичных диаграммах приводятся 6 электронов p-орбитали - и все в одну линию, хотя электроны эти занимают сначала неспаренные позиции, а уже потом 3 раза припариваются (на которые могут выйти потом при возбуждении, что говорит об их повышенной энергии); а также в таких диаграммах не учитываются проскоки электронов с внешних слоёв...
П. С.: химию только пытаюсь освоить
Ну во-первых, можно просто посчитать на компе.
Во-вторых, орбиталь электрона, это выдуманное понятие. Электроны неразличимы, и их волновые функции друг от друга зависят, поэтому разделение на орбитали это грубое приближение, которое рождается из идеи. что электрон ощущает как бы среднее воздействие других электронов (это конечно не так).
В-третьих, по поводу проблемы 2. Эти электроны имеют одинаковую энергию, (даже в приближении одного электрона), так как задача с p орбиталями симметрична, и не важно как они входили в атом, главное что теперь выдергивая любой p электрон, ты будешь получать одинаковый по энергии ион. (можно конечно учесть спин-орбитальное взаимодействие) тогда надо не орбиталей энергию смотреть а спин-орбиталей.
В-четвертых. Зачем тебе это?
У людей со школы голова засрана планетарной моделью и созвучием слов "орбиталь" и "орбита". Отсюда такие дурацкие вопросы, как у ОПа. В вузе потом тяжело студентам объяснять всё с начала. Проще было бы с нуля.
 13 Кб, 350x187
13 Кб, 350x187такие пояснения лишают меня той малой доли понимания, которая была.. ) поэтому я вынужден спорить;
зачем? для понимания физической природы атома
>орбиталь электрона, это выдуманное понятие. Электроны неразличимы
на прилагаемой картинке - разрез атомных орбиталей, которые возможно разглядеть подобным и даже более фотографичным образом в специальные приборы; т. е. каждую орбиталь можно увидеть отдельно и узнать её радиус, что наврняка и было сделано; но я не знаю, как это найти, так как не владею терминологическим аппаратом
>>53278
ничем у меня не засрана, не надо такую чушь писать
>на прилагаемой картинке - разрез атомных орбиталей, которые возможно разглядеть подобным и даже более фотографичным образом в специальные приборы
На картинке орбитали водородоподобного атома, для которого есть точное решение. У других атомов предполагают большую похожесть на водород, но всё-таки там всё сложнее. И отдельную орбиталь увидеть нельзя, можно лишь электронную плотность получить. (но она то от всех электронов в атоме получается)
В книгах по строймолу и квантам атомы подробно изучаются, но без базы, думаю тяжело будет понять что и как.
>2. Эти электроны имеют одинаковую энергию, (даже в приближении одного электрона), так как задача с p орбиталями симметрична, и не важно как они входили в атом
но если я отрываю электрон от фтора, то разве это не будет определённый электрон, который повлияет на его магнитность?
ещё добавлю; часто в учебниках звучит (что-то наподобие, просто передаю суть): 5 электронов [2p'2p'2p'-- -- --][3s'3s,] устойчивее, чем они же, но [2p'2p'2p'2p,2p,--] { разные спины я отобразил как ' и , }; где мне найти таблицу этих "устойчивостей"?
>можно лишь электронную плотность получить
а разве нельзя вычесть из неё прочие (предыдущие, изученные) функции и получить её в относительно чистом виде?
>>53284
>В книгах по строймолу и квантам
книги по химии не могу понять; последняя надежда - на сводные таблицы экспериментальных данных, графики и прочее, о чём и вопрошаю; я хочу понять химию физически, а не алгебраически
 29 Кб, 697x501
29 Кб, 697x501> определённый
Не, принципиальная неразличимость, кстати, и делает зависимость энергии от спинов. Их различают лишь для общей понятности, но лучше всего рассматривать электроны атома как что-то цельное. Поэтому физики и химики пользуются понятием "терма". Терм, это состояние атома, то что ты написал, это два разных терма. У первого твоего примера суммарный орбитальный момент 0, суммарный момент спиновый 3/2, поэтому терм записывают как 4S3/2 это основное состояние атома азота. Другое его состояние, у тебя с суммарным моментом 1, и суммарным спином 1/2 такой терм обозначили бы как 2L3/2 и он менее устойчив просто по причинам кулоновских и обменных взаимодействий. На пике табличка для термов углерода.
Но это больше нужно для спектроскопии, чем для чистой химии. Но желание разобраться с самого начала похвально, но увы, уровень вкатывания в это высок, но слава богу химию можно и без этого начинать понимать.
>>53292
>нельзя вычесть из неё прочие (предыдущие, изученные)
Дело в том, что они все друг на друга влияют. Уже в атоме гелия, если мы принимаем что оба электрона летают как бы на 1s орбитали (ну немного другого размера), то получается энергия атома гелия -74,80еВ а точное значение -79,02eВ. Всё дело в том, что реальная волновая функция учитывает взаимные расположения электронов, а наша модельная упрощенная, нет.
Берёшь такой в своей лабе фильтр подходящего размера и фильтруешь
Попробуй чайный пакетик или чёт в этом роде
http://www.quarkon.ru/physics/shell.htm
- в достаточной степени академичен? Какая есть литература на этот счет?
>Зачем в учебниках до сих пор дается несколько моделей строения атомов?
Школьники тупые. Ты им не можешь кванты затереть. Поэтому дают в историческом режиме.
Тема: Строение атома. Четверть или треть любого учебника по квантовой механике.
>>53346
Очерк ни о чём. Атомы такие атомы, только из-за запрета Паули. Если бы его не было, то все атомы оказались бы как благородные газы, а на 1s оболочку помещалось бы любое число электронов.
>>53346
>есть литература на этот счет?
Берешь университетские учебники по физике. Сивухин, ЛЛ, квантовая механика Мессиа. Или берешь учебники строймола. Для общего понимания лучше взять химические учебники, где просто выводы уже написали по поводу строения атомов и свойств. А когда уже освоишься, бери тяжелые. В школьных учебниках конечно этого нет, и быть не может.
А осаждение соляным раствором даёт достаточно концентрированный осадок, чтобы отравиться испарениями ботулотоксина?
Он не летучий. Но он ПИЗДЕЦ КАКОЙ ЯДОВИТЫЙ. Там нанограммы убивают нахуй. Аэрозольные частицы раствора захавал, и через три дня мертвый.
 162 Кб, 420x495
162 Кб, 420x495А ну да, теперь все понятно.
Либо алгебраическое болото, либо вздорная историческая беллетристика.
>Либо алгебраическое болото
Ничего не поделать. (но алгебраическое болото на самом деле превращается в образы перед глазами, когда матан понимаешь). Для начала посмотри в первом томе Неорганической химии под ред. Третьякова. Там основа для химии.
 24 Кб, 432x618
24 Кб, 432x618>под ред. Третьякова
Откуда он взял данные об энергиях орбиталей для всех элементов? Это ведь экспериментальные данные, а не теоретические, насколько я понимаю
Такой ворос: в учебнике Ахметова дан график орбитальных радиусов элементов. Речь идет о суммарном электронном поле или о радиусе только внешнего/валентного электрона?
>Это ведь экспериментальные данные, а не теоретические, насколько я понимаю
Теоретические. Экспериментально это хрен проверишь. Электроны одинаковые, орбитали это выдуманное упрощение и выдергивая один электрон, всё остальное меняется. А энергия орбитали, это гипотетическая энергия отрыва электрона, при неизменных остальных орбиталях (физически невозможная вещь).
>Речь идет о суммарном электронном поле или о радиусе только внешнего/валентного электрона?
Я даже учебник открыл, там написан ответ с самого начала.
 96 Кб, 595x389
96 Кб, 595x389>физики и химики пользуются понятием "терма". Терм, это состояние атома, то что ты написал, это два разных терма
Это понятие заменяет собой учебниковые {n,m,s,l} или является дополнением к ним? Если дополняет, то физической сущности квантовых чисел я не понимаю. А мне нужно понять, представить, что вообще есть такое атом, вместе со всеми его электронами. Например, p-орбиталь имеет форму гантели - это так и есть ведь, с позиции координат пространства? Это ведь опредленно влияет на форму образующихся из таких атомов молекул (стереохимия там), то есть можно положить, что электрон занял эту позицию, пусть это будет [2p'], а дальше, если спин значения энергетического не имеет, то логичным становится, что не известно, на какую позицию напрыгнет следующий электрон - на [2p'2p'](две неспаренных гантели по осям X и Y), или на [2p'2p,](одна спаренная гантеля). Но для химической связи это же значение имеет; также имеет оно значение и для магнетизма.
 26 Кб, 398x575
26 Кб, 398x575>учебник открыл, там написан ответ
"максимум плотности внешних электронных облаков"
Хорошо. В таком случае, как мне вычислить те внутренние радиусы, которые даны на рис. 14 (прикреплено)? Видно, что для бора и неона общая электронная плотность представлена суммой отдельных орбиталей, а не просто радиальным срезом.
А если под слоем жидкости хранить его, он не опасен? И, вообще, насколько актуальны эти слова для результата простого осаждения botulотоксина соляным раствором? Он действительно будет неебаться каким концентрированным в осадке? Промышленным способом там ещё бактериальные клетки кислотой растворяют, потом в буфере очищают и т. д.
Для атома водорода (1 электрон):
Точное решение ур. Шредингера известно. Оно дает волновые функции для всех орбиталей, из них можно получить плотность орбитали, радиальное распределение, найти его максимум или эквиденситную поверхность - поверхность, внутри которой окажется 0.90 или 0.95 (от балды берется) плотности. Последнее нужно для визуального представления, для s орбиталей это будут сферы, для p - гантели и так далее. Это именно эквиденситные поверхности для ВОДОРОДОПОДОБНОГО атома. Что из этого радиус орбитали, решать тебе, особенно для не s орбитали.
Для атома не водорода (несколько электронов):
Точного решения ур. Шредингера нет. Исходят из предположения, что орбитали выглядят примерно так же (например, если больше протонов в ядре, то одна и та же орбиталь будет более сжатой из-за кулоновского притяжения). Откуда мы знаем, что предположение работает и как находят тогда те же параметры орбиталей (плотности, распределения)? Квантово-химическими расчетами. Точно решить ур. Шредингера нельзя, зато можно численно. А вот на том, как это сделать достаточно точно, возникла целая область еще в то время, когда никаких компьютеров и в помине не было, и уже тогда стало ясно, что да, орбитали неводородного атома выглядит примерно так же. Тогда это был метод Хартри-Фока, которым считали на бумаге (ну или что тогда было), сейчас ты можешь освоить любой пакет для квант-хим расчетов и на любом слабом компьютере посчитать орбитали любого изолированного атома. Энергии орбиталей оттуда сразу же будут известны.
Насколько я помню, решить ур. Шрёдингера можно и для таких ионов как He(+) или Li (2+). Разуеемтся, с некой коррекцией.
Да, для одноэлектронных систем. Потому что пропадает корреляция электронов и сопутствующие проблемные члены в гамильтониане.
CAS: 1533-45-5
Молекулярная формула: C28H18N2O2
Химическое название: Бензоксазол,2,2’-(1,2-этенедилди-4,1-фен)бис
Вы видите копию треда, сохраненную 14 февраля 2019 года.
Можете попробовать обновить страницу, чтобы увидеть актуальную версию.
Скачать тред: только с превью, с превью и прикрепленными файлами.
Второй вариант может долго скачиваться. Файлы будут только в живых или недавно утонувших тредах. Подробнее
Если вам полезен архив М.Двача, пожертвуйте на оплату сервера.
![PS[1].jpg](/sci/big/thumb/443094/15316528657770s.jpg)
![ae1eabe2385ffab3be26d752644ddae2[2].png](/sci/big/thumb/443094/15316528657791s.jpg)
![tumblrlojn9gO34h1qmvtyoo1400[1].jpg](/sci/big/thumb/443094/15316528657802s.jpg)