Вы видите копию треда, сохраненную 27 октября 2017 года.
Можете попробовать обновить страницу, чтобы увидеть актуальную версию.
Скачать тред: только с превью, с превью и прикрепленными файлами.
Второй вариант может долго скачиваться. Файлы будут только в живых или недавно утонувших тредах. Подробнее
Если вам полезен архив М.Двача, пожертвуйте на оплату сервера.
из того что намешал только это и получается. даже тупой догадается что если h2so4+hi=i2+... то с йодом уже ничего не произойдет
HI3
>Ага, только и растворимость, и летучесть, и диссоциация это просто самые прямые следствия термодинамики
Термодинамические параметры - это интегральная оценка с огромным числом факторов. Ты мне собрался доказать, что вот эти экспоненциальные зависимости - близки к линейным? https://en.wikipedia.org/wiki/File:Temperature-entropy_chart_for_steam,_US_units.svg
Диссоциация - это pKa=[H][A]/[HA]. Простая прямая характеристика материи. Если ты скажешь, что в процессе реакций работает закон сохранения энергии, то я тебе подтвержу, что да, так и происходит. Но закон сохранения никак не описывает направление движения энергии.
Ты бы еще написал, что растворимость, летучесть, и дисоциация - это прямые следствия математики, чтоб уж совсем все с ног на голову перевернуть в своем слепом поклонении книжкам и заимствованым знаниям в общем.
>в курсе какая блять энергия Гиббса образования воды?
В курсе. Тебе при каком давлении и температуре?
>>409306
>эксперимент под теорию не подгонишь.
На самом деле есть много умельцев, но это скорее специфика современой "науки".
>>409308
>А вот и сочинение-рассуждение от стандартного говновара
У меня к тебе нескромный вопрос: ты сколько за свою жизнь реакций провел?
>>409317
>вся хуйня, которую мне в школе втюхивали, все эти реакции, мнимые закономерности с миллионом исключений, это всего-лишь по сути эмпирический набор данных о том какая реакция как получилась?
Да, имено так и есть. А термодинамика - это числовое выражение эмпирической оценки. Все это нужно для того, чтобы планировать действия, а не слепо тыкаться в потемках как химики 17-го века.
Скажи честно, очень сложно интуитивно эти графики чувствовать? Плюс в давлениях от 1 до 5 атмосфер, и температурах от 0 до 300 градусов, вполне себе линейные. Мы же вообще весь разговор начали именно как предсказывать для комнатных условий, направления обычных стандартных реакций.

Я ебусь в глаза - не вижу никаких разговоров про стандартные условия. Здесь? >>409257 Или здесь? >>409258
Тем более, что даже школьнику-долбоебу не представляет сложности достижение нестандартных условий где-то так в рамках -15...100 °C, где наблюдается целых два излома в графике энтропии.
И даже если забить на эти изломы, то все равно энтропия меняется, а энергия гибса - это у нас энтальпия минус энтропия помноженая на температуру (G = H - TS). И вот это самое TS получается приближено равным то ли T·sqrt(T), то ли каким-то кубическим корням на коротком отрезке. О чем я тебе изначально и писал про десяток "если", а когда все эти если удовлетворены - зачем твоя термодинамика нужна? Все самые интересные условия остались за бортом, ты работаешь в узком тунеле из экспериментально известных условий ("если").
какой-то непонятный вопрос. NO у тебя что - вещество или ион? Задай поточнее. Ну и посмотри степени окисления азота
не то что окисления, а степени окисления. ЗНаешь степени окисления характерные для атомов и ионов - будешь легко записывать реакции и образующиеся вещества
>>409432
Перечитай определение числа Авогадро в вики, должно помочь + http://900igr.net/datas/fizika/Davlenie-gaza/0015-015-V-1811-g.-Avogadro-vyskazal-predpolozhenie-chto-chislo-chastits-v.jpg
Короче,
n(моль)=m(г)/M(г/моль)=N(молекулы или атомы)/Na, где Na - число Авогадро.
В случае а) M(SO2)=64 г/моль. Значит, 128 г SO2 содержит n(SO2)=m(SO2)/M(SO2)=128 г/64 г/моль=2 моля. Теперь, N(SO2)=n(SO2)Na=2 моль6,0210^23 моль^-1 = 12,0410^23 (молекул). Дальше сам.
3. Наверное, имеется в виду, что данных простых веществах количество атомов равно количеству молекул. Расчеты такие же.
>>409433
Задачка на понимание. Сразу можно сказать, что 6, 12, 6. Правильное и досканальное решение приведено тут:
https://znanija.com/task/5295379
>N(SO2)=n(SO2)Na=2 моль6,0210^23 моль^-1 = 12,0410^23 (молекул)
Обосрался с разметкой:
N(SO2)=n(SO2) x Na=2 моль x 6,02 x 10^23 моль^-1 = 12,04 x 10^23 (молекул)
>>409427
>>409431
>>409441
Взял, забил в гугл NO - получил первый релевантный запрос в виде википедии:
Оксид азота(II), (мон(о)оксид азота, окись азота, нитрозил-радикал) NO
Вот тебе и валентность в скобках.
Двойная ковалентная полярная связь, и одна донорно-акцепторная, как и в молекуле угарного газа.
Ты же понимаешь, что ты приводишь сложные примеры, которые только в лабе будут, или сложные реакции над которыми приходится думать. А обычно задача получить такое соединение, которое еще никто не получал, и данных по нему вообще нет. Но тот парень вообще не знает химию, ему бы понять почему идут реакции обмена в ту сторону. Или ОВР в ту или иную. Для этого лучше всего просто прикидывать именно терму. Даже рассуждая в голове, ты всегда прикидываешь именно её. Он конкретно спросил про реакцию NaOH+HCl
Тут первое что придет любому человеку в голову, тупо Гиббс. Любые мысли про "это хороший окислитель" или "это хорошая кислота" это уже отсылки к большим потенциалам или константам диссоциации, а это тупо уже Гиббса энергия. Ты и так это постоянно делаешь, запоминаешь их. Может быть косвенно. Как нас учили в школе? Выпадает осадок, значит идет. Опять же это тупо посыл в сторону ПР, а ПР это exp(-G/RT). Потом ты уже подключаешь в свои рассуждения кинетику, особенно когда думаешь о органических реакциях. И в любом случае, любое запоминание свойств это фактически запоминание физических свойств, тут кому уже как удобно. Мне удобнее например помнить диаграммы Фроста. А кому-то "сравнительные реакции" где один другого окисляет. Суть одна.
У моей мамки лаба, она мне в ней борщ варит: в одном лаб девайсе мясо хранит, в другом специальном лаб девайсе на рефлюксе его варит.
>"это хороший окислитель" или "это хорошая кислота" это уже отсылки к большим потенциалам или константам диссоциации, а это тупо уже Гиббса энергия
А это не тупо энергия Гибса, ее может там и не быть, поскольку она производна и воображаема. Простому школьнику и даже практику энергия Гибса не нужна, даже если он изучает вопрос экзотермичности реакции в практическом аспекте. Вот написать работу научную, нарисовать красивые формулы - это да, тут сразу энергия Гибса, замечательные графики, апроксимации, и другие заполнители места.
Только при определении кинетики и энергии активации я вижу смысл считать энергии, и то один хрен будет калибровка, и опираться ты будешь на условные единицы.
>Ты и так это постоянно делаешь, запоминаешь их
Не делаю, не запоминаю. Постояно суют мусор в свои работы в Ватостане, чтобы придать значимость своим никчемным работам, написаным за оклад в 15 000 рублей.
>Как нас учили в школе? Выпадает осадок, значит идет. Опять же это тупо посыл в сторону ПР, а ПР это exp(-G/RT)
В даном случае экспонента взята от балды, потому что похожа на наблюдаемую закономерность. Нормальное распределение более полно описывает этот вопрос У него по краям функции близки к экспонентам. потому практически нет никакой проблемы брать экспоненту, если действие происходит в некоторых узких рамках, то есть для малорастворимых солей, для которых ПР применимо.
>Мне удобнее например помнить диаграммы Фроста
В диаграме Фроста значащим является наклон. У меня недавно люто пригорело, когда я пытался по такой диаграме разобраться, что с чем может реагировать, потому что нужно прикладывать линейку, транспортир, и сравнивать ебаные углы. Намного проще и точнее посчитать все это в цифрах.
>>409468
Потому что я нихуя не понимаю эту тему. Я знаю только что оно есть, но почему оно так есть - не понимаю.
>>409447
Корбон монооксид, вон, настолько радикал, что аж ни с чем не реагирует при нормальных условиях.
У моей мамки лаба, она мне в ней борщ варит: в одном лаб девайсе мясо хранит, в другом специальном лаб девайсе на рефлюксе его варит.
>"это хороший окислитель" или "это хорошая кислота" это уже отсылки к большим потенциалам или константам диссоциации, а это тупо уже Гиббса энергия
А это не тупо энергия Гибса, ее может там и не быть, поскольку она производна и воображаема. Простому школьнику и даже практику энергия Гибса не нужна, даже если он изучает вопрос экзотермичности реакции в практическом аспекте. Вот написать работу научную, нарисовать красивые формулы - это да, тут сразу энергия Гибса, замечательные графики, апроксимации, и другие заполнители места.
Только при определении кинетики и энергии активации я вижу смысл считать энергии, и то один хрен будет калибровка, и опираться ты будешь на условные единицы.
>Ты и так это постоянно делаешь, запоминаешь их
Не делаю, не запоминаю. Постояно суют мусор в свои работы в Ватостане, чтобы придать значимость своим никчемным работам, написаным за оклад в 15 000 рублей.
>Как нас учили в школе? Выпадает осадок, значит идет. Опять же это тупо посыл в сторону ПР, а ПР это exp(-G/RT)
В даном случае экспонента взята от балды, потому что похожа на наблюдаемую закономерность. Нормальное распределение более полно описывает этот вопрос У него по краям функции близки к экспонентам. потому практически нет никакой проблемы брать экспоненту, если действие происходит в некоторых узких рамках, то есть для малорастворимых солей, для которых ПР применимо.
>Мне удобнее например помнить диаграммы Фроста
В диаграме Фроста значащим является наклон. У меня недавно люто пригорело, когда я пытался по такой диаграме разобраться, что с чем может реагировать, потому что нужно прикладывать линейку, транспортир, и сравнивать ебаные углы. Намного проще и точнее посчитать все это в цифрах.
>>409468
Потому что я нихуя не понимаю эту тему. Я знаю только что оно есть, но почему оно так есть - не понимаю.
>>409447
Корбон монооксид, вон, настолько радикал, что аж ни с чем не реагирует при нормальных условиях.
Окай, не радикал. Переменную валентность имеют нерадикалы NO+ и CO с похожими свойствами.
Чувак, я тебе уже говорил тут >>409439
Прочитай/перечитай страницу о числе Авогадро на вики. Там все, что тебе надо знать:
> Число Авогадро, константа Авогадро, постоянная Авогадро — физическая величина, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества. Определяется как количество атомов в 12 граммах (точно) чистого изотопа углерода-12. Обозначается обычно как Na, а иногда и L.
В таких задачах Na обычно берут равным 6,02х10^23
> Моль — количество вещества, которое содержит NA структурных элементов (то есть столько же, сколько атомов содержится в 12 г 12С), причём структурными элементами обычно являются атомы, молекулы, ионы и др. Масса 1 моля вещества (молярная масса), выраженная в граммах, численно равна его молекулярной массе, выраженной в атомных единицах массы.
Если все это записать при помощи формул, то получается: n=N/Na; n=m/M, или n=m/M=N/Na. И это соотношение лучше запомнить(для полноты картины можно дописать n=V/Vm, но подозреваю, что ты этого еще не проходил).
Кроме того, по опыту, логическое мышление не приходит само, чтобы его развить надо вначале очень хорошо выучить все определения и формулы, а потом уже твой мозг сам установит между ними связь.
Так, у нас есть 1 моль глюкозы. По определению, он содержит ахуенно большое количество молекул(представь их как большие шарики), аж 6,02х10^23. Однако, если присмотреться, то эти большие шарики состоят из более мелких шариков, которые называют атомами. В одном большом шарике их 24, причем трех разных типов. Далее, тебе дана эмпирическая формула данной молекулы C6H12O6, из которой ясно, что в ней 6 атомов углерода(черные шарики), 12 водорода(белые шарики) и 6 кислорода(красные шарики). Теперь, по нашим предыдущим подсчетам, у нас 6,02х10^23 молекул глюкозы(больших шариков). И в каждой из этих молекул по 6 атомов углерода(черные шарики), 12 водорода(белые шарики) и 6 кислорода(красные шарики). Так сколько всего, например, черных шариков в этой куче? Ну, если ты помнишь умножение, то 6х6,02х10^23(потому что на каждый большой шарик приходится по 6 шариков черного цвета). Это у нас N(c), число всех атомов углерода в нашей куче. Теперь, что следует сделать, чтобы узнать сколько там молей? Опять смотрим определение моля(если забыл), это такое количество вещества в котором Na(=6,02х10^23) структурных единиц, в данном случае, атомов. Значит, чтобы узнать, сколько у нас молей атомов углерода, число всех атомов углерода надо разделить на число Авогадро. n(c)=N(c)/Na=6х6,02х10^23/6,02х10^23=6 (моль).
Вроде описал достаточно подробно
Чувак, я тебе уже говорил тут >>409439
Прочитай/перечитай страницу о числе Авогадро на вики. Там все, что тебе надо знать:
> Число Авогадро, константа Авогадро, постоянная Авогадро — физическая величина, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества. Определяется как количество атомов в 12 граммах (точно) чистого изотопа углерода-12. Обозначается обычно как Na, а иногда и L.
В таких задачах Na обычно берут равным 6,02х10^23
> Моль — количество вещества, которое содержит NA структурных элементов (то есть столько же, сколько атомов содержится в 12 г 12С), причём структурными элементами обычно являются атомы, молекулы, ионы и др. Масса 1 моля вещества (молярная масса), выраженная в граммах, численно равна его молекулярной массе, выраженной в атомных единицах массы.
Если все это записать при помощи формул, то получается: n=N/Na; n=m/M, или n=m/M=N/Na. И это соотношение лучше запомнить(для полноты картины можно дописать n=V/Vm, но подозреваю, что ты этого еще не проходил).
Кроме того, по опыту, логическое мышление не приходит само, чтобы его развить надо вначале очень хорошо выучить все определения и формулы, а потом уже твой мозг сам установит между ними связь.
Так, у нас есть 1 моль глюкозы. По определению, он содержит ахуенно большое количество молекул(представь их как большие шарики), аж 6,02х10^23. Однако, если присмотреться, то эти большие шарики состоят из более мелких шариков, которые называют атомами. В одном большом шарике их 24, причем трех разных типов. Далее, тебе дана эмпирическая формула данной молекулы C6H12O6, из которой ясно, что в ней 6 атомов углерода(черные шарики), 12 водорода(белые шарики) и 6 кислорода(красные шарики). Теперь, по нашим предыдущим подсчетам, у нас 6,02х10^23 молекул глюкозы(больших шариков). И в каждой из этих молекул по 6 атомов углерода(черные шарики), 12 водорода(белые шарики) и 6 кислорода(красные шарики). Так сколько всего, например, черных шариков в этой куче? Ну, если ты помнишь умножение, то 6х6,02х10^23(потому что на каждый большой шарик приходится по 6 шариков черного цвета). Это у нас N(c), число всех атомов углерода в нашей куче. Теперь, что следует сделать, чтобы узнать сколько там молей? Опять смотрим определение моля(если забыл), это такое количество вещества в котором Na(=6,02х10^23) структурных единиц, в данном случае, атомов. Значит, чтобы узнать, сколько у нас молей атомов углерода, число всех атомов углерода надо разделить на число Авогадро. n(c)=N(c)/Na=6х6,02х10^23/6,02х10^23=6 (моль).
Вроде описал достаточно подробно
> Линейные имиды карбоновых кислот получают ацилированием первичных или вторичных амидов ангидридами, галогенангидридами, изопропениловыми эфирами карбоновых к-т или кетенами.
Ой, тут только приблизительно. Значит смотри:
1. Берешь количество атомов во Вселенной.
Количество атомов в наблюдаемой Вселенной составляет по разным оценкам от 4 × 1079 до 1081.
https://ru.wikipedia.org/wiki/Число_Шеннона
2. https://ru.wikipedia.org/wiki/Распространённость_химических_элементов.
3. Определяешь по градиенту распространённости количество атомов умножением общего числа атомов на значение
Концентрация (по массе).
4. Умножаешь эти числа на молярную массу каждого элемента.
5. Суммируешь.
6. Добавляешь ± погрешность, т. к. элементы больше железа, синтезируются в результате его распада,
при гамма-расчеплении во время взрыва сверхновых типа 1А - и в незначительных количествах существуют во Вселенной.
Там образуется большое количество нейтронов и α-частиц, и марганца и других элементов - при фоторасщеплении железа
56Fe + γ → 13 4He + 4 1n на заключительной стадии эволюции.
https://www.youtube.com/watch?v=C0MUi0XzgC8
а мне интересно - вы синтезы вот таких веществ просите ради интереса, ради самой реакции? Или у них есть какое-то применение?
Чем концептуально химия отличается от физики?

>По оценкам, их 10^24
Что? Кого их?
>значит их, 10/6 моль.
Хуйню написал...
Число Авогадро: 6,02214129·1023 моль−1
1024 / 6,02214129·1023 моль−1 = 1.66053892103 моль.
Маловато будет для Вселенной...
>Умножаешь эти числа на молярную массу каждого элемента.
Ой, там не на молярную массу умножать надо, а разделить на число Авогадро. Умножение на молярную массу - даст массу вещества, его количество в молях.
кто-то из вас все равно на 20 порядков ошибся(предполагаю что он имел в виду моли)
>То что вещества, это ты сам придумал.
>Тысячи ты же используешь для чего угодно, и дюжины для чего угодно,
>и моли тоже можно для чего угодно.
А я считал количество моль звезд.
Это ты? https://otvet.mail.ru/question/91537373
Моль - это единица измерения, по-другому она называется — грамм-молекула.
Эта единица измерения - тесно связана с числом Авогадро.
А именно - пикрелейтед.
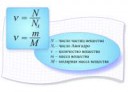
ν = N/NA; где ν - количество вещества, N - количество частиц этого вещества, NA - число Авогадро.
При этом, число Авогадро - является константой, т. е. постоянной величиной,
называется ещё константа Авогадро - и имеет следующее значение:
NA = 6,022 141 29(27)·1023 моль−1
Эта константа - характеризует количество частиц, содержащихся в веществе, количество которого равно 1 моль.
1 моль звёзд не может быть.
Но если ты имел в виду равно ли количество звёзд количеству частиц, содержащихся в одном моле вещества,
т. е. числу Авогадро, другими словами - содержит ли Вселенная как минимум 6,022 141 29(27)·1023 звёзд,
то вопрос не совсем удачно поставлен.
Однако вот что надыбал:
— сверхскопления в наблюдаемой вселенной = 10 миллионов;
— галактические группы в наблюдаемой вселенной = 25 миллиардов;
— гигантские галактики в наблюдаемой вселенной = 350 миллиардов;
— карликовые галактики в наблюдаемой вселенной = 7 триллионов;
— звезды в наблюдаемой вселенной = 30 миллиардов триллионов (3×1022).
Последнее число - ответ на твой вопрос. 22 степень, на порядок меньше 23-й, а множител 3 в два раза меньше 6.
Но это вовсе не значит, что звёзды в галактиках, и скоплениях галактик, которые идентифицированы телескопами,
т. е. звёзды, содержащиеся внутри этого числа - являются всеми возможными звёздами, которые есть во Вселенной.
Возможно есть одинокие звёзды, в местах настолько далёких, насколко далеки эти галактики и скопления галактик,
но которые даже не могут быть наблюдаемы, например звёзды типа Коричневый карлик, которые почти не излучают,
и являются потухшими.
Тогда, вполне естественно, количество звёзд превысит 23-ю степень, и число Авогадро это самое...
А я же, что сделал - взял формулу:
ν = N/NA; N - загуглил, оно равно 4 × 1079 - согласно Википедии, NA - известно,
затем - разделил одно на другое и получил количество вещества, равное 6.6421557e+55,
т. е. 6.6421557×1055 моль.
Измеряется оно в молях, поэтому вот тебе и моли эти твои.
Пруф: https://www.google.com/search?q=(410%5E79)+%2F+(6%2C0221412910%5E23+моль%5E-1)

>То что вещества, это ты сам придумал.
>Тысячи ты же используешь для чего угодно, и дюжины для чего угодно,
>и моли тоже можно для чего угодно.
А я считал количество моль звезд.
Это ты? https://otvet.mail.ru/question/91537373
Моль - это единица измерения, по-другому она называется — грамм-молекула.
Эта единица измерения - тесно связана с числом Авогадро.
А именно - пикрелейтед.
ν = N/NA; где ν - количество вещества, N - количество частиц этого вещества, NA - число Авогадро.
При этом, число Авогадро - является константой, т. е. постоянной величиной,
называется ещё константа Авогадро - и имеет следующее значение:
NA = 6,022 141 29(27)·1023 моль−1
Эта константа - характеризует количество частиц, содержащихся в веществе, количество которого равно 1 моль.
1 моль звёзд не может быть.
Но если ты имел в виду равно ли количество звёзд количеству частиц, содержащихся в одном моле вещества,
т. е. числу Авогадро, другими словами - содержит ли Вселенная как минимум 6,022 141 29(27)·1023 звёзд,
то вопрос не совсем удачно поставлен.
Однако вот что надыбал:
— сверхскопления в наблюдаемой вселенной = 10 миллионов;
— галактические группы в наблюдаемой вселенной = 25 миллиардов;
— гигантские галактики в наблюдаемой вселенной = 350 миллиардов;
— карликовые галактики в наблюдаемой вселенной = 7 триллионов;
— звезды в наблюдаемой вселенной = 30 миллиардов триллионов (3×1022).
Последнее число - ответ на твой вопрос. 22 степень, на порядок меньше 23-й, а множител 3 в два раза меньше 6.
Но это вовсе не значит, что звёзды в галактиках, и скоплениях галактик, которые идентифицированы телескопами,
т. е. звёзды, содержащиеся внутри этого числа - являются всеми возможными звёздами, которые есть во Вселенной.
Возможно есть одинокие звёзды, в местах настолько далёких, насколко далеки эти галактики и скопления галактик,
но которые даже не могут быть наблюдаемы, например звёзды типа Коричневый карлик, которые почти не излучают,
и являются потухшими.
Тогда, вполне естественно, количество звёзд превысит 23-ю степень, и число Авогадро это самое...
А я же, что сделал - взял формулу:
ν = N/NA; N - загуглил, оно равно 4 × 1079 - согласно Википедии, NA - известно,
затем - разделил одно на другое и получил количество вещества, равное 6.6421557e+55,
т. е. 6.6421557×1055 моль.
Измеряется оно в молях, поэтому вот тебе и моли эти твои.
Пруф: https://www.google.com/search?q=(410%5E79)+%2F+(6%2C0221412910%5E23+моль%5E-1)
Ссылка пруфца поехала из-за звёздочки... Кстати, там и крестик работает, поэтому - вот новый пруфец:
https://www.google.com/search?q=(4×10^79)+/+(6,02214129×10^23+моль^-1)
самофикс
Моль можно употреблять и синонимично, а не только к количеству вещества, и да. Отвязали от граммов. Это не грамм-молекула, это просто моль^-1.

>Моль можно употреблять и синонимично, а не только к количеству вещества, и да. Отвязали от граммов.
>Это не грамм-молекула, это просто моль^-1.
ИМХО, единица измерения у числа Авогадро связана лишь с тем, что количество частиц N - представляет из себя число,
т. е. является безразмерной величиной [1].
И т. к. единицей измерения количества вещества исторически является [моль], то исходя из формулы:
ν = N/NA; NA × ν = N; N/ν = NA;
и при проведении операций с единицами измерения,
[1]/[моль] = [1/моль] = [моль-1], где безразмерная величина N - измеряется в [1],
так как когерентной производной единицей для безразмерной производной величины является число один.
https://ru.wikipedia.org/wiki/Безразмерная_величина
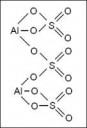
Алюмосульфат-ион, комплексный ион.
Смотри комплексные соединения.
У него заряд - -1.
Потому что гидратированный алюмосульфат калия имеет химическую формулу KAl(SO4)2 · 12H2O
Чем концептуально отличается ебля в жопу от бурения скважины? Одно и то же ведь почти.
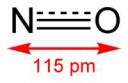
KI c избытком 40% серной кислот - в парах слабокислая реакция и характерный режущий запах, йод в осадок не выпадает и очень неохотно экстрагируется из раствора:
2H2SO4 + 2KI => KHSO4 + SO2↑ + KI3
KI с концентрированной серной, режущий запах в парах, позже - запах сероводорода. При разбавлении можно обнаружить йод и серу, наличие трийодида неизвестно:
xH2SO4 + xKI => xSO2 + xS↓ + xH2S↑ + xI2
Какого хуя идет реакция 2HI + S => H2S + I2, учитывая тот факт, что в воде при н.у. она идет в обратную сторону? Скорее всего решает высокая температура в смеси (порядка 200°C), хотя для того, чтобы она хорошо шла, на самом деле нужно порядка 400°C.
Загадкой является даже вот такие вот полуреакции:
HSO4− + 3 H+ + 2 e− ⇌ SO2(aq) + 2 H2O (+0.16)
I2(s) + 2 e− ⇌ 2 I− (+0.54)
Как я понимаю, это потенциалы для NaHSO4 и NaI, а H2SO4 обладает более высоким потенциалом, увеличивающимся с концентрацией. У кого-нить есть инфа по теме?
Итак, отвечая на свой же вопрос "H2SO4 + HI + I2 => ?":
- в случае как разбавленной, так и концентрированной кислоты нет значительных отличий реакции с/без йода, разве что в соотношении продуктов (если пропустить выходные газы через I2, то будет реакция H2S + I2 => 2HI + S);
- однако, если вместо HI используется NaI или KI (H2SO4 + NaI + I2), то реакция как минимум сильно замедляется, если вообще идет. Это неплохой способ получить кислый раствор трийодида.
>>409663
Дебик, -3 это суммарная степень(слишком давно это решал, не уверен, что так называется) окисления для 3 атомов йода. Например, ты не знаешь, какая степень окисления у азота в данном соединении, но легко угадать, что с ним связан фторид, у которого она -1. -1*3=-3 => степень окисления азота - +3.
ну типо все просто. есть ХF3 там три фтора, если мы знаем что фтор 1-, то 1-*3=3- бинго! Или же если мы знаем что у Х 3+, то 0-3+=3- опять же БИНГО
мне как-то поебать, я про другое втираю
и, да вроде правильные. я вроде даун, но знаю соединение NF3 и то что у фтора -1, значит вроде верно
Все эти определения хуита. Серьезно. Они типа все правильные. Но когда такое происходит, сразу ясно, что с самим определением что-то не то. Я вот недавно увидел прекрасное определение молекулы и молекулярного иона. "Это электронная плотность содержащая в себе больше одного ядра".
да
если мне не изменяет память, то в сопряженных системах не все так просто, типо полуторные связи и прочая дичь.

Сап химанон. Где-то был сайт, где можно проверить идут ли реакции и в каком направлении
и условия их - может знает кто ссыль, не?
Дело вот в чём: вот эта реакция идёт или не идёт?
BaO2 + CO2 + H2O = BaCO3 + H2O2
Если идёт, то какие условия?
И вообще, у кого нибудь есть пероксид бария? Знаю только, что его где-то в пиротехнике юзают...
https://www.youtube.com/watch?v=P3L1G_ThBRY
Может ли анон, с пруфами, кинуть этого пероксида бария - в бутылку газировки
или же тупо залить сей пероксид бария этой газировкой?
Там внутри, вроде угольная кислота образуется:
CO2 + H2O ⇄ H2CO3
И потом, походу, будет вот чо:
BaO2 + H2CO3 -> BaCO3 + H2O2
Или же не, и там не так всё?
Не пойму, там будет перекись выделяться в растворе, или же просто кислород будет?
Алсо вот: чувствительной качественной реакцией на перекись водорода
является реакция с фенолфталеином в присутствии одной капли 0,01 М раствора сульфата меди.
В щелочной среде даже в присутствии следов перекиси водорода появляется фиолетовое окрашивание.
И вот ещё одна качественная реакция:
Наливают в пробирку 2 мл полученного раствора H2O2,
2 мл разбавленного раствора H2SO4, 0,5 мл эфира (диэтилового)
и добавляют несколько капель раствора хромата калия.
В присутствии перекиси водорода в кислой среде хроматы (а также бихроматы) образуют
интенсивно окрашенные надхромовые кислоты по реакции:
H2CrO4+2H2O2=H2CrO6+2H2O
Какова роль эфирного слоя? А как раз и служит в качестве индикатора.
Надхромовая кислота более растворима в эфире, чем в воде.
При взбалтывании разбавленного водного раствора ее с небольшим количеством эфира
получают в последнем концентрированный раствор надхромовой кислоты,
обладающей красивой синей окраской.
В присутствии только 0,1 мг хромовой кислоты всплывающий наверх эфирный слой
окрашивается в интенсивно синий цвет даже в присутствии 0,007 мг хромовой кислоты
еще заметно синее окрашивание эфира.
https://www.youtube.com/watch?v=YcQQGiZNG3c

Сап химанон. Где-то был сайт, где можно проверить идут ли реакции и в каком направлении
и условия их - может знает кто ссыль, не?
Дело вот в чём: вот эта реакция идёт или не идёт?
BaO2 + CO2 + H2O = BaCO3 + H2O2
Если идёт, то какие условия?
И вообще, у кого нибудь есть пероксид бария? Знаю только, что его где-то в пиротехнике юзают...
https://www.youtube.com/watch?v=P3L1G_ThBRY
Может ли анон, с пруфами, кинуть этого пероксида бария - в бутылку газировки
или же тупо залить сей пероксид бария этой газировкой?
Там внутри, вроде угольная кислота образуется:
CO2 + H2O ⇄ H2CO3
И потом, походу, будет вот чо:
BaO2 + H2CO3 -> BaCO3 + H2O2
Или же не, и там не так всё?
Не пойму, там будет перекись выделяться в растворе, или же просто кислород будет?
Алсо вот: чувствительной качественной реакцией на перекись водорода
является реакция с фенолфталеином в присутствии одной капли 0,01 М раствора сульфата меди.
В щелочной среде даже в присутствии следов перекиси водорода появляется фиолетовое окрашивание.
И вот ещё одна качественная реакция:
Наливают в пробирку 2 мл полученного раствора H2O2,
2 мл разбавленного раствора H2SO4, 0,5 мл эфира (диэтилового)
и добавляют несколько капель раствора хромата калия.
В присутствии перекиси водорода в кислой среде хроматы (а также бихроматы) образуют
интенсивно окрашенные надхромовые кислоты по реакции:
H2CrO4+2H2O2=H2CrO6+2H2O
Какова роль эфирного слоя? А как раз и служит в качестве индикатора.
Надхромовая кислота более растворима в эфире, чем в воде.
При взбалтывании разбавленного водного раствора ее с небольшим количеством эфира
получают в последнем концентрированный раствор надхромовой кислоты,
обладающей красивой синей окраской.
В присутствии только 0,1 мг хромовой кислоты всплывающий наверх эфирный слой
окрашивается в интенсивно синий цвет даже в присутствии 0,007 мг хромовой кислоты
еще заметно синее окрашивание эфира.
https://www.youtube.com/watch?v=YcQQGiZNG3c
Нигма подходит по описанию: http://nigma.ru
Вводишь в строку поиска нужные вещества, тебе высвечивает реакции с их участием. Иногда там много, иногда одна, иногда ничего.

Вижу, там вода присутствует в реакции.
Так вот, растворимость пероксида бария в воде 0,091 г/100 г. Значит, он уйдёт в осадок.
С чистой водой, пероксид бария реагирует так:
BaO2 + 2H2O ⇄ Ba(OH)2 + H2O2
И да, я знаю откуда ты вытащил эту пасту. Это был сайт: http://znaesh-kak.com/fe/perekis-vodoroda.html
При этом, чуть выше, там же - написано следующее:
"Перекись обладает слабыми кислотными свойствами. Это подтверждается её взаимодействием со щелочью:
Ba(OH) + H2O2 = 2H2O + BaO2 перекись бария"
При этом, растворимость гидроксида бария в воде - составляет 3,89 г/100 мл при (20 °C),
что куда больше растворимости перекиси бария, и гидроксид бария тоже выпадет в осадок в чистой воде,
как и пероксид его, ну и сама перекись смешивается с водой.
Так что вангую в чистой воде с пероксидом бария - смесь:
H2O, H2O2, Ba(OH)2, BaO2.
В определённых пропорциях, которая образует насыщенные растворы всех этих веществ.
Ну а если CO2 пропускать, то и BaCO3 на днище осядет.
Дальше... Углекислый газ под давлением. Под каким давлением? Куда его обычно пропускают?
Алсо, без H2O - вполне вероятна реакция:
2 BaO2 + CO2 -> 2BaCO3 + O2
Т. е. без всяких перекисей.
я тут не поленился и открыл вики. как бэ реакция идет так BaO2+H2O=Ba(OH)2 Ba(OH)2 + CO2= BaCO3. Думаю последняя реакция плохо идет.
сам составляй
>Думаю последняя реакция плохо идет.
Как раз-таки хорошо. Вот она, в конце видео:
https://www.youtube.com/watch?v=glmCe0s6jnc
Просто дует в трубку, в выдыхаемом воздухе углекислый газ, и мутнеет баритовая вода там.
Бульбашки большие поднимаются, потому что раствор какой-то вязкий становится.
А вот первая, походу - хреново идёт.
>>409803
>С водой образует кристаллогидраты BaO2•8H2O и BaO2•H2O.
Ну, теперь понятно, почему они нерастворимы эти кристаллы.
>Нужен надпероксид и взлетит.
Для получения надпероксида бария BaO4 - пероксид надо нагревать при непонятной температуре, причём в избытке кислорода и под высоким давлением - непонятно какой величины.
BaO2 + O2 -> BaO4
При этом, удерживая или даже повышая давление - охлаждать этот надпероксид, поскольку образующееся вещество неустойчивое и разлагается свыше 50 °C.
Я так понимаю, при снижении температуры и удержании давления, разложение будет повышать это давление, пока температура не упадёт до 50 градусов, а при ниже 50 градусов получить надпероксид можно при наличии ещё более высокого давления, как-бы вдавливающего кислород в кристаллическую решётку пероксида, лол.
Зато, надпероксид легко разлагается водой — с образованием перекиси водорода:
BaO4 + 2H2O -> Ba(OH)2 + H2O2 + O2
И кислород можно использовать повторно, зажимая в компрессоре, например.
Но тут, смотри какая хрень получается...
По мере роста концентрации перекиси, должна протекать ещё такая реакция:
Ba(OH)2 + H2O2 = 2H2O + BaO2
продукты которой свяжутся в кристаллогидрат и выпадут в осадок, лол.
При этом целевое вещество, перекись, разрушается, и на выходе - только кислород.
Суммарно, всё это можно записать так:
BaO4 + 9 H2O= BaO2•8H2O↓ + BaO2•H2O↓ + O2↑
и никакой перекиси ∩(^_^)
>Думаю последняя реакция плохо идет.
Как раз-таки хорошо. Вот она, в конце видео:
https://www.youtube.com/watch?v=glmCe0s6jnc
Просто дует в трубку, в выдыхаемом воздухе углекислый газ, и мутнеет баритовая вода там.
Бульбашки большие поднимаются, потому что раствор какой-то вязкий становится.
А вот первая, походу - хреново идёт.
>>409803
>С водой образует кристаллогидраты BaO2•8H2O и BaO2•H2O.
Ну, теперь понятно, почему они нерастворимы эти кристаллы.
>Нужен надпероксид и взлетит.
Для получения надпероксида бария BaO4 - пероксид надо нагревать при непонятной температуре, причём в избытке кислорода и под высоким давлением - непонятно какой величины.
BaO2 + O2 -> BaO4
При этом, удерживая или даже повышая давление - охлаждать этот надпероксид, поскольку образующееся вещество неустойчивое и разлагается свыше 50 °C.
Я так понимаю, при снижении температуры и удержании давления, разложение будет повышать это давление, пока температура не упадёт до 50 градусов, а при ниже 50 градусов получить надпероксид можно при наличии ещё более высокого давления, как-бы вдавливающего кислород в кристаллическую решётку пероксида, лол.
Зато, надпероксид легко разлагается водой — с образованием перекиси водорода:
BaO4 + 2H2O -> Ba(OH)2 + H2O2 + O2
И кислород можно использовать повторно, зажимая в компрессоре, например.
Но тут, смотри какая хрень получается...
По мере роста концентрации перекиси, должна протекать ещё такая реакция:
Ba(OH)2 + H2O2 = 2H2O + BaO2
продукты которой свяжутся в кристаллогидрат и выпадут в осадок, лол.
При этом целевое вещество, перекись, разрушается, и на выходе - только кислород.
Суммарно, всё это можно записать так:
BaO4 + 9 H2O= BaO2•8H2O↓ + BaO2•H2O↓ + O2↑
и никакой перекиси ∩(^_^)
Пероксиды: https://ru.wikipedia.org/wiki/Категория:Пероксиды
Надпероксиды: https://ru.wikipedia.org/wiki/Категория:Надпероксиды
Фториды: https://ru.wikipedia.org/wiki/Категория:Фториды
Но там далеко не всё.
Трийодид калия. Кристаллогидрат.
Он, скорее всего - образуется, когда йод связывается с йодидом калия в водном растворе:
I2 + KI + H2O -> KI3⋅H2O
Возможно поэтому, йод и не экстрагируется оттуда.
Короче, смотрел в пероксид кальция - не понял ничего,
в итоге нашёл рубидий, а именно - его гидроксид.
Значит так:
Пропусканием кислорода через расплав гидроксида рубидия - получают надпероксид рубидия.
Плавится же RbOH - при 301 °C (по другим данным 382 °C).
(450 °C) 4RbOH + 3O2 -> 4RbO2 + 2H2O
Здесь, чистый кислород - значит надо подавать снизу под давлением,
ну, чтобы пузырьки поднимались вверх, а расплав не протекал вниз.
Но пероксид рубидия - гигроскопичен, поэтому надо, наверное отгонка паров воды.
Дальше, надпероксид рубидия плавится при 540 °C.
При 450 °C он будет кристаллизироваться наверху, потому что плотность его меньше:
(RbO2 - 3,06 г/см3, а у RbOH - 3,203 г/см3).
Это будет мешать отгонять пары, значит это всё надо бы перемешывать, чтобы корка не образовывалась сверху.
При этом сам пероксид - неустойчив и при дальнейшем нагревании в вакууме — отщепляет кислород.
Значит, надо понизить давление, и плавно увеличить температуру:
(400-800 °C) RbO2 -> Rb2O2; Это - был пероксид рубидия.
У него температура плавления (570; 600 °C)
(1010 °C) Rb2O2 -> Rb2O; А это был - оксид рубидия.
Этот плавится уже при 505 °C и будет жидким при такой температуре.
Кислород, при пониженном давлении выделяется тут и давление ещё больше нужно снижать значит,
как-бы извлекая этот кислород.
Дальше... Окисление оксида рубидия стехиометрическим количеством кислорода (по молям рассчитано чтоб было)
под небольшим давлением даёт - триоксид рубидия:
(200 °C)2Rb2O + 2O2 -> Rb4(O2)3
Т. е. тут надо понизить температуру оксида рубидия до 200 градусов, и плавно вернуть назад
часть из того кислорода, который выделялся при понижении давления и в процессе разложения.
Триоксид рубидия плавится при 489 °C, в отличие от оксида рубидия (505 °C), и разлагается назад в оксид при 900 °C.
Плотность у триоксида рубидия 3,7 г/см3, по сравнению с оксидом 3,72 г/см3,
и значит он будет наверху жидкий, в расплавленном виде, а оксид - внизу кристаллизироваться.
И вот уже сам триоксид рубидия — взаимодействует с водой (по разному при разных температурах):
(0 °C) Rb4(O2)3 + nH2O -> 2Rb2O2•nH2O + O2;
(??) Rb4(O2)3 + 4H2O -> 4RbOH + H2O2;
Если вода горячая - значит, походу, сценарий второй, и будет перекись на выходе.
При этом, назад, как я понимаю вторая реакция — уже не идёт, т. е. перекись никак не взаимодействует с образующимся гидроксидом рубидия,
и т. к. RbOH хорошо растворим, то раствор будет насыщенным, а при испарении и даже кипении перекиси при 150,2 °C - будет происходить
кристаллизация гидроксида рубидия в насыщенном растворе перекиси.
Вода же уйдёт полностью в пары и выкипит - уже при 100 градусах.
Можно было бы снизить давление и осущить смесь кислорода с парами воды каким-нибудь водоотнимающим средством.
Что получается?
Ёмкость с соединениями рубидия, один нагреватель, термометр с терморегулятором, шланг с водой, возможно распылитель какой-нибудь,
миксер чтоб мешать расплавы и растворы, если нужно, один компрессор, который работает в режиме снижения и повышения давления,
ёмкость для кислорода чтобы возвращать можно было его, и подача кислорода как сверху, так и снизу.
Всё это должно держать максимальную температуру 1010 °C, змеевик для конденсации паров, холодильник...
Кислород должен быть чистым - воздух не подходит, поэтому можно пихнуть шланг от электролизёра воды для его получения.
Суммарная реакция:
2H2O + O2 -> 2H2O2, на выходе пары перекиси, и концентрированная перекись после конденсации паров.
Короче, смотрел в пероксид кальция - не понял ничего,
в итоге нашёл рубидий, а именно - его гидроксид.
Значит так:
Пропусканием кислорода через расплав гидроксида рубидия - получают надпероксид рубидия.
Плавится же RbOH - при 301 °C (по другим данным 382 °C).
(450 °C) 4RbOH + 3O2 -> 4RbO2 + 2H2O
Здесь, чистый кислород - значит надо подавать снизу под давлением,
ну, чтобы пузырьки поднимались вверх, а расплав не протекал вниз.
Но пероксид рубидия - гигроскопичен, поэтому надо, наверное отгонка паров воды.
Дальше, надпероксид рубидия плавится при 540 °C.
При 450 °C он будет кристаллизироваться наверху, потому что плотность его меньше:
(RbO2 - 3,06 г/см3, а у RbOH - 3,203 г/см3).
Это будет мешать отгонять пары, значит это всё надо бы перемешывать, чтобы корка не образовывалась сверху.
При этом сам пероксид - неустойчив и при дальнейшем нагревании в вакууме — отщепляет кислород.
Значит, надо понизить давление, и плавно увеличить температуру:
(400-800 °C) RbO2 -> Rb2O2; Это - был пероксид рубидия.
У него температура плавления (570; 600 °C)
(1010 °C) Rb2O2 -> Rb2O; А это был - оксид рубидия.
Этот плавится уже при 505 °C и будет жидким при такой температуре.
Кислород, при пониженном давлении выделяется тут и давление ещё больше нужно снижать значит,
как-бы извлекая этот кислород.
Дальше... Окисление оксида рубидия стехиометрическим количеством кислорода (по молям рассчитано чтоб было)
под небольшим давлением даёт - триоксид рубидия:
(200 °C)2Rb2O + 2O2 -> Rb4(O2)3
Т. е. тут надо понизить температуру оксида рубидия до 200 градусов, и плавно вернуть назад
часть из того кислорода, который выделялся при понижении давления и в процессе разложения.
Триоксид рубидия плавится при 489 °C, в отличие от оксида рубидия (505 °C), и разлагается назад в оксид при 900 °C.
Плотность у триоксида рубидия 3,7 г/см3, по сравнению с оксидом 3,72 г/см3,
и значит он будет наверху жидкий, в расплавленном виде, а оксид - внизу кристаллизироваться.
И вот уже сам триоксид рубидия — взаимодействует с водой (по разному при разных температурах):
(0 °C) Rb4(O2)3 + nH2O -> 2Rb2O2•nH2O + O2;
(??) Rb4(O2)3 + 4H2O -> 4RbOH + H2O2;
Если вода горячая - значит, походу, сценарий второй, и будет перекись на выходе.
При этом, назад, как я понимаю вторая реакция — уже не идёт, т. е. перекись никак не взаимодействует с образующимся гидроксидом рубидия,
и т. к. RbOH хорошо растворим, то раствор будет насыщенным, а при испарении и даже кипении перекиси при 150,2 °C - будет происходить
кристаллизация гидроксида рубидия в насыщенном растворе перекиси.
Вода же уйдёт полностью в пары и выкипит - уже при 100 градусах.
Можно было бы снизить давление и осущить смесь кислорода с парами воды каким-нибудь водоотнимающим средством.
Что получается?
Ёмкость с соединениями рубидия, один нагреватель, термометр с терморегулятором, шланг с водой, возможно распылитель какой-нибудь,
миксер чтоб мешать расплавы и растворы, если нужно, один компрессор, который работает в режиме снижения и повышения давления,
ёмкость для кислорода чтобы возвращать можно было его, и подача кислорода как сверху, так и снизу.
Всё это должно держать максимальную температуру 1010 °C, змеевик для конденсации паров, холодильник...
Кислород должен быть чистым - воздух не подходит, поэтому можно пихнуть шланг от электролизёра воды для его получения.
Суммарная реакция:
2H2O + O2 -> 2H2O2, на выходе пары перекиси, и концентрированная перекись после конденсации паров.
>Вы знали это ? я не знал
Если не знал, то лучше разбераться почему так.
Смотри, у иона водорода — степень окисления +1. Поэтому Валентность водорода принимают за I (единицу).
Валентность не имеет знака — она не может быть ни положительной, ни отрицательной, в отличие от степени окисления.
У кислотных остатков, как правило, степень окисления и заряд ионов - отрицателен.
И потому как валентность выражается числом, валентность кислотных остатков численно равна количеству атомов водорода в кислотах,
т. е. количеству одиночных связей кислотного остатка с ионами водорода.
>Как эта тема называется ?
Электролитическая диссоциация. Метод электронно-ионного баланса.
Окислительно-восстановительные реакции. Степени окисления.
>Можно ли восстановить N-пропилацетамид до пропилэтиламина в домашних условиях, если у тебя есть металлический натрий и 99,9% ИПС? Количественно?
ноуп. или лаг или боран можно из боргидрида и эфирата диметилсульфид
Вот что ещё нашёл для получения перекиси:
BaO2 + 2HCl (конц., хол.) = BaCl2 + H2O2
(150,2 °C) перегонка перекиси
(900—950°C) BaCl2 + H2O(пар) = BaO + 2HCl - с отгонкой хлороводорода, походу.
(500-520°С) 2BaO + O2 -> 2BaO2; - при снижении температуры.
Но вот тут https://ru.wikipedia.org/wiki/Пероксид_бария
написано, что эта реакция обратима, при 500 градусах, а значит давление нужно будет приложить, чтоб равновесие сместить.
И не пойму, там чистый кислород надо, или же просто воздух? Потому что вот здесь пишется - что достаточно кислорода из воздуха:
http://chemister.ru/Database/properties.php?dbid=1&id=379
Способы получения BaO2:
1. Нагревание оксида бария с воздухом при 500-520°С в присутствии паров воды (катализатор).
2. Термическое разложение нитрата бария при 500-540°С.
Что касается нитрата бария - при температуре свыше 670 °C разлагается до оксида бария.
2Ba(NO3)2 = 2BaO + 4NO2 + O2;
Выделяющийся диоксид азота - в воде растворяется:
2NO2 + H2O -> HNO3 + HNO2;
Но азотистую кислоту в азотную не так просто перевести, порой выделяется NO, который окисляется до NO2.
Но если растворение проводить в избытке кислорода, образуется только азотная кислота (NO2 проявляет свойства восстановителя):
4NO2 + 2H2O + O2 -> 4HNO3
В общем, вернуть азотную кислоту в оборот из нитрата можно.
Но не совсем понятно, вот этот пероксид бария с азотной кислотой даёт перекись или нет?..
Может там при воздействии азотной кислоты вообще кислород или озон выделяется, не?
>>409912
Какой-то Сергей Симонов. Фотка гуглится.
Это химии тред. Мочератор подчисть хуиту.
Чтобы было дохуя.
Полимеры вполне себе длинные молекулы.
P.s. А когда гомологический ряд алканов кончается и начинается самый простой органический полимер вида CH3-{CH2-CH2}n-CH3? Кстати по номенклатуре как он должен называться? Полиметан или полиметил?
Да, нашёл какую-то пероксиазотную кислоту, которую получают так:
N2O5 + H2O2(безводн.) = HNO3 + HNO4
Но сама азотная кислота, вроде как прямо - не окисляется перекисью, по реакции:
HNO3 + H2O2 -> HNO4 + H2O
Скорее всего, так пойдёт реакция, как с диоксидом свинца:
BaO2 + HNO3 + H2O2 = Ba(NO3)2 + O2 + H2O
Но не факт, что будет именно так, поэтому у химиков и спрашиваю.
Достаточно знать, что значит понятие амфотерность - это означает проявление как кислотных, так и щелочных свойств.
Вон, на картинке тождество.
Гидроксид алюминия и его кислотная форма - ортоалюминиевая кислота.
Это одно и то же соединение. С натрием, например, гидроксид алюминия образует алюминат натрия Na3AlO3.
Ну а дальше - смотри сам, надо оно тебе или нет... Лично мне - неинтересно.
>алюминат натрия Na3AlO3
Хотя стоп. По идее, должен был бы.
Но не вижу такого вещества.
Вижу только такое...
Al(OH)3 + NaOH = Na[Al(OH)4]
И вот такое:
Al(OH)3 + NaOH = Na3[Al(OH)6]
Самая большая проблема . читаю пособие , хочу зайти в инэт а там слишком много инфы .
Я всегда картинки смотрю .Так получается из одной темы можно всю тетрадь законспектировать
В узком смысле под основаниями понимают основные гидроксиды — сложные вещества,
при диссоциации которых в водных растворах отщепляется
только один вид анионов — гидроксид-ионы OH−.
https://ru.wikipedia.org/wiki/Основание_(химия)
Если оксид, взаимодействуя с водой даёт основной гидроксид,
либо если гидроксид, который разлагается в оксид - является основным гидроксидом,
то оксид является основным.
Например:
Li2O + H2O -> 2LiOH (щелочь, основной гидроксид) - значит оксид основной.
Но назад ты его не получишь.
Другой пример - разложение гидроксида алюминия:
2Al(OH)3 -> Al2O3 + H2O (первый, амфотерный гидроксид) - значит и оксид Al2O3 - амфотерный.
Но гидроксид ты не получишь - реакция назад не идёт.
Реакция триоксида хрома с водой:
CrO3 + H2O -> H2CrO4 (хромовая кислота) - значит оксид кислотный.
Но назад ты его не получишь... Только разложением хромата какого-нибудь, походу...
Короче, оксиду с водой - соответствует некий гидроксид
(кислота, амфотерный гидроксид, или щелочь, т. е. основной оксид),
и какой гидроксид - такой и оксид, и не важно идёт реакция с водой или нет,
ведь она может идти и в обратном направлении.
Чтобы мне понять эти определения , надо проходить диссоциацию ?
Нет, достаточно запомнить валентности химических элементов в оксидах,
и то, что у OH- иона - валентность I.
Ну, чтобы по валентности определить формулу соответствующего гидроксида.
А затем классифицировать эти гидроксиды, т. е. понять,
какой оксиду соответствует гидроксид - основной, амфотерный, или кислотный,
дабы определить какой оксид соответственно.
Но с кислотными гидроксидами - всё не так.
Например, валентность углерода IV, валентность OH- - I,
гидроксид получается C(OH)4 или H4CO4, но такого нет, ему соответствует H2CO3.
Значит OH-ионов нет в достаточном количестве, как и водорода, а кислород — связан c углеродом.
Гидроксид проявляет кислотные свойства, а вот почему - смотри уже в диссоциацию.
Да вот КНИТУ заканчиваю по специальности " технология тугоплавких неметаллических и силикатных материалов"(стекло, керамика, вяжущие)
>Взрывное устройство, при срабатывании которого получил тяжелые травмы 17-летний молодой человек в Санкт-Петербурге, было изготовлено самим пострадавшим.
>Из материалов уголовного дела следует, что несовершеннолетний — студент первого курса одного из петербургских вузов. Увлекаясь химией, он изготовил самодельное взрывное устройство.
>Сейчас подросток находится в больнице. Следственные действия следователи начнут проводить с ним по согласованию с врачами, только после того как позволит состояние его здоровья. Ранее сообщалось, что у него травматическая ампутация кисти.
Настоящий химик. Только обычно таким не кисть отрывает а пару пальцев, но этот какой-то видимо жадный оказался.
Na[Al(OH)4] = NaH2(Al)O3 ⋅ H2O
Na3[Al(OH)6] = Na3AlO3 ⋅ 3H2O
Ещё, вижу есть Na2AlO2OH,
который моно представить, как Na2HAlO3.
NaAlO2 + NaOH = Na2HAlO3
из времен ссср или современый ?
Оба. Чтобы знать предмета придется прочесть более 9000 книг. Более того умные люди читают книги и еще и пишут свои.
И эти книги потом никто не читает. Чтобы понимать основные идеи и владеть базовыми практиками, нужно довольно скромный период обучения, более того, относительно мало связанный с чтением книг.
У кислорода валентность 2 по умолчанию. Для оксида. Есть конечно пероксиды и надпероксиды.
Поэтому зная валентность гидроксильной группы OH- - она составляет I, восстанавливаешь валентность металла,
и сохраняя его валентность - образуешь формулу его оксида с двухвалентым кислородом.
Вот скажи мне почему ты дебильный такой и зачем ты сюда зашел? Базовый курс != знание предмета.
Разве растворимость связана с валентность?
Просто запомни. Или таблицу напиши, потом меряй эту свою растворимость и сопоставляй.
Спасибо!
да проще выучить основные степени окисления и валентности у элементов и ионов - не так уж сложно, и можно работать
>фтор атнимаит иликтро у вадарода
А почему?На пикриле фтор становится с излишним электроном, разве частицы не стремятся к нейтральности?
Нет атомы стремятся завершить энергетический уровень
Из-за принципа запрета Паули из квантовой механики. Если бы его не было, то да, всё стремилось бы к нейтральности. А в итоге существуют разные орбитали, и различные оболочки.
Заебал, хватит "учить" химию. Разберись что и как. Начни со строения атома, потом радиусы, потом энергии ионизации и сродства к электрону. Потом уже думай про химические свойства.
Если это есть в контрольных вопросах, значит надо знать.
Для кого же написано? Для чего написано?
Разве это сложно запомнить, блядь?
Называются оксокислотами. Ну охуеть теперь. Почему называются? Да потому что оксиген там.
Пшёл вон. Гайки крутить, скорее твой удел.
А что касается кислотообразующих элементов - глянь названия следующих кислот:
серная кислота, азотная кислота, углекислота, кремниевая кислота, хлорная кислота (HClO4),
борная кислота, хромовая кислота, марганцевая кислота, мышьяковая.
Все их названия - содержат кислотообразующий элемент, и ничего более.
И все эти кислоты, согласно химическим формулам являются оксокислотами.
алсо есть такая фича в названиях кислот, например:
1. Серная, хлорная, азотная - все кислоты с элементов в высшей степени окисления (S+6, Cl +7, N +5)
2. Сернистая хлористая, азотистая - элементы в низкой и промежуточной степеня окисления (s+4, Cl +3, N +3)
3. По поводу фторо-, хлороводородных - пнятненько
4. неохота расписывать про поли-, мета-, ортокислоты

не успеваю одну тему в день проходить с учетом того что у меня еще год впереди
Я думаю что надо только самое важноу
Гугли хромирование, никелирование, серебрение, золочение, меднение.
Лучше химическое, и электролитическое,
можно диффузное, но не пары металла же осаждать.
А то там придётся его до кипения доводить металл, походу.
https://www.youtube.com/watch?v=eIn8TqgvPa0
https://www.youtube.com/watch?v=KFcaPxjW_ik
https://www.youtube.com/watch?v=b2tSgIZ2SXI
Алсо, есть составы, например вот: http://impgold.ru/introduce/book/4_5/
Только тот гипофосфит натрия NaPO2H2 разлагается с выделением фосфина ph3, а этот - ядовит.
Как видишь, здесь: https://www.youtube.com/watch?v=7-v9-QU7ec0
- два шланга в распылителе этом с форсункой, и туда реагенты подаются.
Смешиваясь на детали, происходит реакция, которая приводит к восстановлению металлического хрома на её поверхности.
Пик1 - хромированный диск от колеса авто.
Пик2 - никелированные пружинки какие-то.
Пик3 - золочение.
Пик4 - ТОЛСТО ПОЗОЛОЧЕННЫЙ ВОЛЬФРАМ.
Вот: https://www.youtube.com/watch?v=mPzwZgTZoyE
гальваническое серебрение.
Основной компонент электролита - хлорид серебра в роданиде. В пиридине тоже растворяется.
Там ещё желтая кровяная соль повышает растворимость.
"Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке. Из-за образования комплексных соединений хлорид серебра заметно растворим в концентрированной соляной кислоте и растворах хлоридов."
— википедия, статья хлорид серебра.
По никелированию:
http://tutmet.ru/nikelirovanie-himicheskoe-blestjashhee-galvanicheskoe-detalej-aljuminija.html
Тут внизу состав с хлоридом никеля и укуснокислым натрием.
А ваще, можно было бы и нагуглить эти составы, и накидать сюда оптимальные такие,
с доступными и растворимыми реагентами в смесях.
Ну, чтоб с помощью одной трубки, форсунки и воздуходува - проводить металлизацию любых поверхностей,
причём без электрохимических реакций, потому что некоторые поверхности не проводят ток.
Стекло, например...
Гугли хромирование, никелирование, серебрение, золочение, меднение.
Лучше химическое, и электролитическое,
можно диффузное, но не пары металла же осаждать.
А то там придётся его до кипения доводить металл, походу.
https://www.youtube.com/watch?v=eIn8TqgvPa0
https://www.youtube.com/watch?v=KFcaPxjW_ik
https://www.youtube.com/watch?v=b2tSgIZ2SXI
Алсо, есть составы, например вот: http://impgold.ru/introduce/book/4_5/
Только тот гипофосфит натрия NaPO2H2 разлагается с выделением фосфина ph3, а этот - ядовит.
Как видишь, здесь: https://www.youtube.com/watch?v=7-v9-QU7ec0
- два шланга в распылителе этом с форсункой, и туда реагенты подаются.
Смешиваясь на детали, происходит реакция, которая приводит к восстановлению металлического хрома на её поверхности.
Пик1 - хромированный диск от колеса авто.
Пик2 - никелированные пружинки какие-то.
Пик3 - золочение.
Пик4 - ТОЛСТО ПОЗОЛОЧЕННЫЙ ВОЛЬФРАМ.
Вот: https://www.youtube.com/watch?v=mPzwZgTZoyE
гальваническое серебрение.
Основной компонент электролита - хлорид серебра в роданиде. В пиридине тоже растворяется.
Там ещё желтая кровяная соль повышает растворимость.
"Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке. Из-за образования комплексных соединений хлорид серебра заметно растворим в концентрированной соляной кислоте и растворах хлоридов."
— википедия, статья хлорид серебра.
По никелированию:
http://tutmet.ru/nikelirovanie-himicheskoe-blestjashhee-galvanicheskoe-detalej-aljuminija.html
Тут внизу состав с хлоридом никеля и укуснокислым натрием.
А ваще, можно было бы и нагуглить эти составы, и накидать сюда оптимальные такие,
с доступными и растворимыми реагентами в смесях.
Ну, чтоб с помощью одной трубки, форсунки и воздуходува - проводить металлизацию любых поверхностей,
причём без электрохимических реакций, потому что некоторые поверхности не проводят ток.
Стекло, например...

Тут составы для цинкования и хромирования:
http://tehtab.ru/Guide/GuideChemistry/SolutionsMixturesMetalls/WaterMetallCovers/WaterMetallCoversGhrome/
Для хромирования - годный последний состав, который внизу, замена гипофосфита натрия, выделяющего ядовитый фосфин.
Пленка наращивается примерно так же быстро, согласно показателям.
Вообще-то гипофосфит натрия при нагревании разлагается, но там всё-равно там яд.
Вот так никелирование идёт в присутствии гипофосфита:
H2PO-2+H2O + Ni2+ = H2PO-3 + 2Н+ + Ni↓
NiCl2 + NaH2PO2 + H2O = Ni↓ + 2HCl + NaH2PO3
Ni2+ +2H = Ni + 2H+;
Ним так идут и золочение, и серебрение и т. д.
По сути, восстановителем в реакциях с гипофосфитом натрия — является атомарный водород.
http://www.alhimik.ru/teleclass/konspect/konsp4-04.shtml
И конечно же, для его получения - лучше всего его непосредственное выделение на катоде, при электролизе воды и растворов солей.
Хранить его бессмысленно, потому что я вас помню. И пошёл себе...
Там сажа. В саже - углерод, фуллёрены, нанотрубки, графен и даже алмазы.
Углерод не растворяется, но может реагировать с перегретым паром.
Важна в промышленности реакция углерода с водяным паром:
C + H2O → C O↑ + H2↑
1. В области низких температур водяной пар практически не взаимодействует с углеродом.
2. При температурах 400 – 1000°С обе реакции практически полностью обратимы, поэтому в составе равновесного газа присутствуют значительные количества водяного пара.
3. При высоких температурах в присутствии твердого углерода водяной пар практически полностью расходуется в результате протекания реакций (2.15) и (2.18).
Угарный газ на выходе - ядовит, но оба продукта реакции - горят.
И смотри как-бы с перегретым паром не прореагировал и металл.
Алсо, пикрелейтед - металлическая щетка для посуды.
На рисунке - алюминий. Его нельзя никаким химическим агентом мыть, потому что он тупо растворяется как в кислоте, так и в щелочи. Если у тебя эмаль, то можно хромпиком отмыть, если же сталь, то можно тупо сжечь, но в итоге все равно придется механически чистить окалину.
>пикрелейтед - металлическая щетка для посуды
Она в этой реакции выступает в роли катализатора?
Там же написано о высшей валентности. С тебя вопрошаются высшые оксиды.
Термин «атомный» или «порядковый» номер обычно используется в атомной физике и в химии, тогда как эквивалентный термин «зарядовое число» — в ядерной физике.
Берёшь таблицу Менделеева, она гуглится и в картинках есть.
Находишь там по порядковому номеру элементы эти свои.
И гуглишь высшие оксиды.
У серы - валентность даже VI бывает в вычшем оксиде, когда серный газ т. е. серный ангидрид. SO3.
Алсо, этот твой SO существует обычно недолго в виде димера S2O2, и очень активно окисляется в более устойчивый SO2.
NaCl, растворимость 35,9 г/100 мл (+25 °C).
KCl, Растворимость в воде при 20 °C = 34.0 г/100 мл.
Скорее всего - один будет вытеснять другой,
пока не получится какой-то равновесный раствор
с наибольшим насыщением в нём растворённых компонентов,
и кристаллизацией менее растворяющихся.
Что-то в виде твёрдых растворов, но это не сплавы.
Твёрдые растворы — фазы переменного состава, в которых атомы различных элементов расположены в общей кристаллической решётке.
Вот, например галлий с индием образуют твёрдый раствор, который сразу плавится.
Причём состав его один и тот же, 76 % галлия и 24 % индия, примерно получается — в результате диффузии.
Температура плавления 16 цельсиев, плотность 6,235 г/см3.
https://www.youtube.com/watch?v=LkI1lihNeH0
Так и с растворами, наверное...
Причём стоит заметить, что:
1. плотность галлия - 5,91 г/см3,
2. плотность индия - 7,31 г/см3,
3. а плотность этого твёрдого раствора 6,235 г/см3.
И в результате воздействия гравитации, он как-бы посредине находится,
а избытки - кристаллизируются либо на дне, либо на поверхности.
Т. е. в растворах, ты скорее всего увидишь либо насыщенный более плотный раствор, с кристаллизацией солей
на днище, либо в виде корки наверху, потому что плотность у них разная. ИМХО, конечно.
>ывает в вычшем оксиде, когда серный газ т. е. серный ангидрид. SO3.
>
Так надо степень окисление или валентность определять ?
Я понял что находиш этот элемент по атомному номеру и прибавляеш к нему (кислород - O) чтобы получить оксид
А так мне понятно что у серы высшая валентность VI
>Так надо степень окисление или валентность определять ?
Высшая валентность атома химического элемента в оксиде, равна номеру группы, в которой он находится.
http://scienceland.info/chemistry8/oxidation-state

Я НЕТОЧНО начертил красным где должны находится металлы одного типа . Мб кто знает как их называют ?
Да.

Ставишь GPU, и через BOINC выполняешь.
А если серьёзно, то вот тебе таблица Менделеева, в нормальном разрешении - скачай её себе, и смотри:
16, 21, 25, 48, 76 - это порядковые номера элементов.
Термин «атомный» или «порядковый» номер обычно используется в атомной физике и в химии, тогда как эквивалентный термин «зарядовое число» — в ядерной физике.
Т.е. порядковый номер равен заряду ядра атома. Вон он, в белых прямоугольниках.
Этим порядковым номерам соответствуют элементы:
S, Sc, Mn, Cd, Os.
Группы элементов - наверху.
Группы у этих элементов, соответственно:
VI, III, VII, II, VIII;
Дальше, юзаешь правило:
Высшая валентность атома химического элемента в оксиде, равна номеру группы, в которой он находится.
Валентность - та же.
И тупо, зная валентность кислорода (II) - лепишь потом высшие оксиды, учитывая эту высшую валентность.
Вот они: SO3, Sc2O3, Mn2O7, CdO, OsO4;
Понял?

В основном, под валентностью химических элементов
обычно понимается способность свободных его атомов
(в более узком смысле — мера его способности)
к образованию определённого числа ковалентных связей.
В пикрелейтед оксиде SO3, валентность серы равна шести,
потому что сера, связываясь с тремя атомами кислорода двойными связями -
имеет валентность VI и связей тоже 6.
Я даже не знаю, кто хуже, необучаемый школьник или уебок, который ему подробно всё пытается объяснить, тем самым стимулируя его присутствие итт.
Ну так эту тупость - надо исключать же.
>уебок, который ему подробно всё пытается объяснить
Да пошёл ты, сам такой. Не нравится - не смотри.
Ты зачем сюда пришёл ITT, мазафакер, уроки-то сделал?
Тут химия, тебе её не понять, блядь. Ещё напиши, "Да."
Что надо добавить к бору что бы он нормально горел?
Серу или галогены, скорее всего.
(400°C) 4B + 3O2 → 2B2O3 (S,Г2)
Источник: http://portal.tpu.ru:7777/SHARED/i/ILYIN/Tab2/InorgChemLectures.pdf
>И в результате воздействия гравитации, он как-бы посредине находится
хуйню несешь. Обычные диаграммы состояния тебе в помощь
спаси и сохрани
очень узкоспециализированная информация. Тащемта везде и пишут про содержание растворенного кислорода в воде, потому что это важный технический показатель.
попробуй тут поискать: Разумовский С.Д. Кислород - элементарные формы и свойства.
Давай сюда эти свои диаграммы. Я по плотности смотрел.
,fvg
>Скорее всего
>ИМХО, конечно.
Ну охуеть, я же элементарную вещь спросил, никто даже толком не знает ответа.
Наверни диффузиофорез.
Правильно мыслю ? ОТвет нашел но не понял
31-16=15.
Атомное ядро — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %).
https://ru.wikipedia.org/wiki/Атомное_ядро

Существует ли, обусловленный эквивалентностью массы и энергии, дефект масс,
при эндотермических и экзотермических химических реакциях, куда входит такое слагаемое, как теплота ±Q?
Или же только при ядерных реакциях наблюдается сей эффект?
Дефект масс это глобальная вещь. И да, существует. Но очень мало. Крайне. При любом изменении энергии будет меняться масса (Теоретическая физика том 2. Теория поля. Ландау Лившиц.)
Это понятно из уравнения эйнштейна E = mc^2;
Но вот на пикрелейтед предыдущего поста - это, походу, термоядерная реакция слияния ядер дейтерия с атомной массой 2,0152 каждый,
и с образованием на выходе ядра гелия3, с двумя протонами, заряд которых положителен,
с одним нейтроном в ядре (нулевой заряд), и одним нейтроном - вылетающим (со знаком минус который). Пик1.
Общая масса их, как четырёх нуклонов - равна примерно массе ядра атома гелия-4, поэтому её туда и вписали.
А вообще, два протона (с плюсами) вместе в одном ядре быть не могут, как и два нейтрона (с нулями наверху).
Пик некорректный.
Но не в этом дело...
В ядерной реакции, носителями энергии могут быть не только фотоны, но и нейтральные нейтрино, пи0-мезоны,
или даже электрон-позитронные пары, т. е. атомы позитрония, которые имеют не только нулевой заряд, импульс и энергию, но ещё и массу.
Я уже молчу за нейтроны. Но последние хоть заметить можно.
Так вот, с их удалением от ядра в результате ядерной реакции вполне можно объяснять дефект масс.
Но это - ядерные реакции.
А тут вот что:
АТФ + Н2О → АДФ + Н3РО4 + 40 кДж/моль. Реакция химическая.
По формуле Эйнштейна, E = mc^2 дефект масс должен был бы быть: 4,45060022×10-13 кг для каждого моля АТФ.
Молярная масса АТФ при этом составляет 507,18 г/моль, и в молях, дефект масс составлял бы 8,77518873 × 10-13 моль.
При этом, если умножить это количество на число Авогадро - получится вот что:
дефект масс в частицах = 5,28454226 × 1011 частиц, т. е. столько молекул АТФ.
Но они же никуда не деваются? Или куда-то деваются? Или они ещё и плюсуются?
https://www.google.com/search?q=40+(кДж)++число+Авогадро+(моль%5E-1)+%2F+(c%5E2++507%2C18+г%2Fмоль)
И дай страницу и параграф в Ландавшице, где об этом написано подробно,
не могу найти, а поиск по тексту не работает, потому что скан.
Из-за звёздочки разметка поехала, поэтому вставил крестик:
https://www.google.com/search?q=40+(кДж)+×+число+Авогадро+(моль^-1)+/+(c^2+×+507,18+г/моль)

У тебя не они деваются, а просто меняется сама молярная масса, атомы начинают весить меньше. Один атом плюс другой атом, весят больше чем молекула из этих двух атомов. Про частицы имеется ввиду ЛЮБЫЕ, хоть ядро, хоть нейтрон, хоть молекула днк.
Еще добавлю хоть две черные дыры. Эта штука реально универсальна. Там дефект измеряется уже в количестве масс солнца.
>Li2O + H2O -> 2LiOH (щелочь, основной гидроксид) - значит оксид основной.
>Но назад ты его не получишь.
Гидроксид кальция разваливается обратно на оксид и воду при прокаливании.
Химико-металлургический факультет политеха, технология органических веществ. Кхн по органике.
>разве частицы не стремятся к нейтральности?
Частицы стремятся к заполнению электронной оболочки, т.е. к восьми электронам на последней после первой. У фтора она 2s22p5, ему надо электрон для завершения уровня.


нахуй иди серьезно, почему ты думаешь тебе будет помогать тут, я за это деньги получаю, а ты хочешь от меня бесплатно советов? или от кого-то еще?
Балбес что ли? Последний - четвертый, 4s2.
я думаю что C правильно ?
А говорят, мол, да это же парижская зелень [(смешанный ацетат-арсенит меди(II)].
Я от такого поворота событий прихуел. И раньше не был фанатом б\у, а уж отъехать от книги и подавно не мечтал.
В связи вопрос к настоящим химикам (ну или к тем, какие уж найдутся).
Похоже? Нахуя?
Что делать, чтобы отличить\нейтрализовать и пр., т.к. меня всё ещё не покидает ощущение, что это может быть всё что угодно, в том числе и типографская краска. Хотя тот, кто книгу послал, утверждал: "что-то могло образоваться за время длительного путешествия посылки", мол, изначально ничего не было.
На плесень не похоже, ибо яркое - да и не разрослось за несколько месяцев.
Может мне и к психиатру, а может к участковому или уже к доктору. Я хуй знает, помогайте, аноны.
Задал тот же вопрос на форуме химиков. Может отправят к психиатру. (Честно, столько дерьма в жизни происходит, что поход в ПНД кажется отдушиной, но не суть.)
Погуглил, сколько стоит хим. экспертиза и понял, что проще либо спросить, либо, не знаю, лизнуть и помереть, либо выучить химию.
Тем более, в случае с Наполеоном там были комнаты обклеенные обоями, а тут, с виду, небольшое количество. Но на Вики, в "волшебном" ромбике стоит цифра 4, мол, очень опасная вещь и какие-то не слишком внушительные (а мне их трудно оценить количественно) гр. для смертельного отравления.
И, да, если всё так просто, чего ж не роскомнадзорятся этой зеленью?
Откуда ты решил что это парижская зелень? полно зеленого дерьма похожего на это.
Ты уверен что такая доза нанесет непоправимый ущерб здоровью хомечка?
Я спросил в \bo\, мне подсказали, на что это может быть похоже (упомянули парижскую зелень). У меня повышенная тревожность по жизни (ипохондрик, короче).
Да, это может быть, например, паста ГОИ, какая-нибудь краска типографская, зелёнка (хотя на зелёнку мало похоже). Много чего.
И даже сама парижская зелень в такой дозировке не смогла бы нанести какой-либо ощутимый вред, подозреваю.
А что могло? Тревога. Понятно, что выбрасывание книг не самый лучший способ (избегающее поведения), тем более, когда книга стоит немалых денег (для книги), но в таком ужасном с точки зрения нервов состоянии (сейчас полно реальных проблем, которые мне давят на мозги, не из области гипотетических ядов и пр., а из области - где бы найти денег на лекарства, что делать с диагностированной серьёзной болезнью, с конфликтами в семье и пр.) я просто пошёл по пути наименьшего сопротивления.
Мне грустно и совестно из-за того, что не могу подавить свою тревогу.
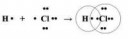
Итак, господа, вопрос такой: почему силикагель стал самой распространенной неподвижной фазой для хроматографии? Его можно перефразировать как "почему силикагель используется вами или вашими коллегами?".
Я недавно прочитал одну статью (не помню какую, да и не имеет значения), в которой авторы последовательно используют колонку с флорисилом, потом ТСХ на целлюлозе, потом распределительную хроматографию на силикагеле для проведения анализов, мол "смотрите, как мы можем, сколькими инструментами владеем". И хоть бы кто смог сказать, почему именно это и нужно ли это вообще.
inb4: у меня в методике написано я не знаю почему а иначе меня выгонят с работы.
>почему силикагель стал самой распространенной неподвижной фазой для хроматографии?
Относительно дешевый, инертный, прозрачный. Хорошо разделяет, хорошо цепляет смолу. Оксид алюминия часто провоцирует всякие разные реакции на колонке.
>Относительно дешевый, инертный, прозрачный. Хорошо разделяет, хорошо цепляет смолу
Какими из этих свойств не обладает, например, флорисил или целлюлоза (микрокристаллическая)?
Оксид алюминия бывает разный, просто снижение ph приводит к снижению активности. В том числе есть нейтральный. В этом плане окись алюминия универсальнее, потому что, например, амины дают хвосты на силикагеле, но идеально разделяются на основном оксиде алюминия.
Ну и как бы я напомню, что как силикагель, так и оксид алюминия в высокоактивном безводном состоянии являются катализаторами разных реакций, обладая выраженными кислотными и основными свойствами, потому в них обязательно должна присутствовать вода.
Ну и еще о флорисиле или целлюлозе для хроматографии мало кто знает.
>например, амины дают хвосты на силикагеле, но идеально разделяются на основном оксиде алюминия
Как раз получил смесь аминов. Завтра попробую поделить на основной окиси.
Флорисил стоит столько, сколько за него поставят цену. Его приготовление и отбор частиц по размеру слабо отличается от процесса приготовления силикагеля. То, что бездари из сорбфила нихуя не могут освоить, кроме аналитических пластин с силиказолевой связкой которые все равно не дотягивают до мерковских, не значит, что другие материалы чем-то хуже или сложнее. А значит лишь то, что в рашке хим отрасли нет. Идея такая: если ее нет, то зачем развивать то, чего нет? Для десятка аналитических лаб и того что есть фатит.
>>411065
>Ну и еще о флорисиле или целлюлозе для хроматографии мало кто знает.
Охуительная история. А ниче, что именно с целлюлозы ТСХ и начиналась? Где-то с 1965-1970 началось бурное развитие ТСХ с упадком бумажной хроматографии в результате разработки хорошо воспроизводимых и производительных методов (сорбентов).
Если ты посмотришь ассортимент мерска, то увидишь там 40 видов пластинок на силикагеле, 11 на обращенной фазе силикагеля, 11 видов на целлюлозе, и 4 на оксиде алюминия (и еще 3 на кизельгуре, но то такое - на любителя). https://www.merckmillipore.com/INTL/en/products/analytics-sample-prep/chromatography-for-analysis/thin-layer-chromatography/tlc-plates-thin-layer-chromatography/.o2b.qB.m_gAAAFAmdhkiQpx,nav
У сигмы соотношение примерно такое же. http://www.sigmaaldrich.com/analytical-chromatography/analytical-products.html?TablePage=18169736
Так что аргументы вроде "мало кто знает про хроматографию на целлюлозе" оставь для институтских профессоров, которые уже и не помнят, когда последний раз делали хроматографию отличную от заученных примеров-демонстраций.
>Где-то с 1965-1970 началось бурное развитие ТСХ
Щас 2017 на дворе, если ты забыл. То поколение химиков давно уже вымерло или на пенсии, древние знания утрачены. По своему опыту, ТСХ - это последнее, за что стоит браться. Есть колоночная хроматография, перекристаллизация, переосаждение и т.д. Большинство задач все-таки можно решить, не прибегая к пластинам, потому что пластины - это долго и муторно, большое количество вещества чистить замучаешься. Если уж все обычные методы не помогают, то тогда да, приходится обмазываться пластинами.
К колонке же подцепил литр растворителя, врубил вакуум и успевай только менять приёмники. Я ничего против ТСХ не хочу сказать, метод рабочий и позволяет что-то выделить даже из конченой грязи, но очень уж геморройно.
Дорогой мой, ТСХ - это аналитика, разработка техпроцесса. Я понимаю, что уровень рашкинского говноварства не подразумевает чего-то большего, чем воспроизведение хорошо известного техпроцесса, но все же.
Ни один аналитический метод не дает столько возможностей работы со смесями, как ТСХ. Это и двухмерная хроматография, в том числе с дерриватизацией на месте, и использование нескольких методов детектирования сразу, и все это на фоне миллипиздрических количеств исследуемого вещества порядка 1 мкг с границей детектирования пятен порядка десятков нанограммов. У ВЭЖХ вполне себе сравнимые возможности разрешения, разве что ТСХ придется делать 20-200 минут, в то время как ВЭЖХ справляется с той же задачей за 4-40 минут, ибо высокое давление. Кстати, ВЭТСХ никто не отменял, но там девайсики нужны соответствующие, там же и возможность создания градиента внезапно появляется.
В институтах учатся по знаниям как минимум десятилетней давности. В принципе, ты прав, в 1995 году уже довольно сильно забыли про бумагу, хотя с алюминия оксидом все-таки периодически работали. В совке адово надрачивали на ВЭЖХ, но я в бугорных статьях нередко вижу что-то вроде "one spot on TLC" и "purified by flash column chromatography".
К колонке же подцепил литр растворителя, врубил вакуум и успевай только менять приёмники.
А типа для ТСХ по простоте исполнения требования не еще ниже? Капнул пробу, налил растворителя, кинул пластину, ушел пить кофеек. Так-то есть и автоматические отборы проб для ВЭЖХ, но есть и автоматически аппликаторы для ТСХ, и автоматика для проведения хроматография со сканированием результатов.
>ТСХ - это аналитика, разработка техпроцесса. Я понимаю, что уровень рашкинского говноварства не подразумевает чего-то большего, чем воспроизведение хорошо известного техпроцесса, но все же.
Что сказать-то хотел? Просто выебнуться? В препаративном отношении это просто пластина определенной формы с сорбентом и индикатором. Устроил тут рашки и говноварство, упырь мел и меньше читай б.
>на фоне миллипиздрических количеств исследуемого вещества порядка 1 мкг
И что ты с ним сделаешь? 13С снимать с одного микрограмма будешь? Кристалл на рентген тоже?
>"purified by flash column chromatography"
Это банальное быстрое пропускание через тонкий слой сорбента.
>А типа для ТСХ по простоте исполнения требования не еще ниже?
Кроме аналитической ТСХ есть еще препаративная ТСХ, гораздо более важная для синтетиков. Пластину надо накатать, аккуратно нанести смесь если нет автосемплера (а его нет), потом все пятна отдельно надо собрать пылесосом с пластины и смыть растворителем.
И какое вещество будет самым лучшим, если спирт не подойдёт? Молоко (дичку же экстрагируют с ним)? А если в кипятке просто попробовать на пару часов проварить, как будет результат?
Понимаю, что занимаюсь хуйнёй, но у меня этого дрянья полкило, а жрать его я уже заебался.
>дичку же экстрагируют с ним
В молоке жир. Жир экстрагентом и является.
>экстрагировать в чистом спирте
Потом бухать мускатную настойку.
Да вот ещё читал, что МО вместе с алкоголем - большой для печени вред, как-то стрёмно будет такую настойку мне хуячить (в особенности, что чистый спирт я хуй знает где найти, придётся шкалики по 50р/100гр брать). Чтобы спирт потом удалить, достаточно будет эту бодягу в кастрюле проварить? Ну и чтобы желательно всё нужное с ним не улетучилось?
Так, я чего-то только щас понял, что так и не понял по поводу
>в молоке жир
Так молоко экстрагирует всё из МО то или нет? Получается, просто можно молоко пожирнее взять, проварить с часик и можно эту шнягу пить?
Братюнь, не обессудь, я в химии вообще ничего не понимаю.
>В препаративном отношении это просто пластина определенной формы с сорбентом и индикатором
А типа ВЭЖХ аппарат особенно по-другому устроен? На самом деле я имел в виду, что ТСХ для анализа неизвестных исходных условий дает больше возможностей, чем ВЭЖХ, для которой ты заранее знаешь оптимальную колонку и растворитель.
>13С снимать с одного микрограмма будешь? Кристалл на рентген тоже?
ИК/раман и масспектры с одного микрограмма прекрасно делаются. Прецизионный ЯМР - это охуительно громоздкая поеботина, которая стоит сотни тыщ зеленых рублей в приобретении и еще столько же в обслуживании.
Собсна, на рентген ты не соберешь за один проход ни с препаративной ТСХ, ни с ВЭЖХ, которые оба дают порядка 100 мкг на хорошо делящихся веществах, а на рентген нужно что-то вроде 2 г.
>Это банальное быстрое пропускание через тонкий слой сорбента.
Не через тонкий, но быстрое, да, без разделения толком.
>Кроме аналитической ТСХ есть еще препаративная ТСХ, гораздо более важная для синтетиков
В рашке не делают препаративных ТСХ. Я об этом и писал, в том числе. Это показатель.
Основная причина использования высокоэффективных хроматографий, будь то газовых или жидкостных или тонкослойных, - это экономия времени высококвалифицированного персонала. Какой нахуй высококвалифицированный персонал в великой россии? Единственная полезная функция, которая есть у японских и американский аппаратов по сравнению с ручным трудом россиян, - это удобство распила бюджетных средств.
>потом все пятна отдельно надо собрать пылесосом с пластины и смыть растворителем
С магния силиката или даже силикагеля на гипсе можно легко собрать слой сорбента, и делать с содержащимся там веществом что угодно.
>ВЭЖХ, для которой ты заранее знаешь оптимальную колонку и растворитель.
А если не знаешь? Обычную колоночную хроматографию ты не рассматриваешь вообще что ли для разделения смесей?
>Прецизионный ЯМР - это охуительно громоздкая поеботина, которая стоит сотни тыщ зеленых рублей в приобретении и еще столько же в обслуживании.
И при этом это самый основной инструмент в работе любого органика. Любое новое вещество начинается с протонника и 13С, потом уже азотные, фосфорные, фторные спектры и т.д. Открой любую статью в любом журнале по органике, что ты там найдешь в экспериментальной части? Спектры ЯМР.
>рентген нужно что-то вроде 2 г.
Что еще придумаешь? На рентген нужно не два грамма, а хороший кристалл, который нужно подбирать. Препаративной ТСХ за пять-шесть пластин вполне можно набрать нужное для рентгена количество. Только его еще надо закристаллизовать хорошо и качественно, а не просто отдернуть растворитель на насосе.
>Не через тонкий, но быстрое, да, без разделения толком.
Для клик-химии и количественных реакций больше и не надо.
>В рашке не делают препаративных ТСХ.
Если ты не делаешь, это не значит, что никто не делает. Несколько раз препаративная ТСХ меня выручала там, где колонки не делили.
>легко собрать слой сорбента
Это если полосы хорошо разделились и далеко разъехались, а если они тонкие и близко расположены - придется подрочиться.
А если не знаешь, то делаешь ТСХ, а по ней уже смотришь варианты для колонок. Так у культурных людей в книжках и рекомендуют делать. Что ты увидишь после колонки? Будешь каждую каплю в отдельную баночку складывать?
>Открой любую статью в любом журнале по органике, что ты там найдешь в экспериментальной части? Спектры ЯМР.
ЯМР, ИК, МС. Но делаются они не после ВЭЖХ/ГХ, в большинстве случаев. ГХ-МС используют в качестве аналитической связки, по ЯМР некоторые умудряются определять чистоту полученного вещества, хотя обычно это делают с помощью ГХ-МС или ВЭЖХ, но я не помню, чтобы я когда-то прочитал, что с помощью ВЭЖХ было очищено вещество, а потом у полученного чистого измеряли температуру плавления, ЯМР, ИК, и прочее.
Во что я поверю, так это в перегонку/кристаллизацию или максимум колоночную хроматографию, чтобы полученное в результате вещество анализировалось на ГХ/ЖХ-МС, ИК, ЯМР, температуре кипения/плавления, а также по тонкослойной хроматографии. Очень важная сфера применения ТСХ - это анализ промежуточных продуктов, для чего некоторые умудряются использовать ЯМР, хотя нередко используют хроматограф-масспектр.
>На рентген нужно не два грамма, а хороший кристалл, который нужно подбирать
Ну я тебе подберу хороший кристалл 3х3х4 мкм под микроскопом. Сделаешь с него рентген?
Последнее, о чем я подумаю для получения граммовых количеств - это ТСХ. Для этой цели делается ТСХ, потом с таким же растворителем и аналогичным адсорбентом делается колонка, где ты точно знаешь Rf целевого вещества.
>Это если полосы хорошо разделились и далеко разъехались, а если они тонкие и близко расположены - придется подрочиться.
Назови мне инструмент, который лучше справится с ситуацией. Плохо разделяющееся вещества - это всегда геморрой, независимо от инструмента. С флорисила снимать сорбент - сплошное удовольствие, но если полосы наехали друг на друга, то с чистотой придется распрощаться.
У нас в институте снимают 40000 спектров ЯМР в год, тебе уже будет лежать протонник через 15 минут как отдал, так некоторые настолько обленились, что кажется что они фракции дают, бывает принесут 10 ампул, а ты видишь на спектре что это блять с колонки, и охуеваешь от ленивости.
другой анон
А теперь посмотри на нытье анонов на этой борде, мол "путин денег мне не дал на ноуку". Вот они, твои деньги, в ЯМР спектрометре. За те же деньги двадцать китайцев-профессоров будут тебе палочками чистить вещества в течении нескольких лет. А ноют потому, что в рашке пиная хуи на месте моченого нельзя толком поднимать норм бабки.
>А если не знаешь, то делаешь ТСХ, а по ней уже смотришь варианты для колонок.
Это все конечно хорошо, но на практике разделение на пластине и на колонке с одним сорбентом и одним растворителем дохуя сильно различается.
>Что ты увидишь после колонки? Будешь каждую каплю в отдельную баночку складывать?
Зависит от вещества. Если окрашено - заебись, собираешь окрашенные полосы, не окрашено - ГЖХ, ТСХ. И да, объединять похожие по ТСХ фракции и тащить на ЯМР. Сорбенты для колонок тоже бывают с индикатором, чтобы можно было лампой светить.
>Но делаются они не после ВЭЖХ/ГХ, в большинстве случаев
Ну естественно, не у каждого же ВЭЖХ стоит.
>по ЯМР некоторые умудряются определять чистоту полученного вещества
Быгыгы, недавно как раз такое было. Притаскивает девочка вещество - черная жижа, а должно быть белыми кристаллами. По ЯМР чистое, убеждает меня. В хроматограф закалываю - лезут два пика одинаковой интенсивности. Вот тебе и чистота по ЯМР.
>Очень важная сфера применения ТСХ - это анализ промежуточных продуктов
Это касается только известных вещей. Если продукты и интермедиаты неизвестны - ТСХ не скажет ничего, кроме количества компонентов в смеси и какого из них больше. А вот по ЯМР уже можно что-то сказать о составе смеси и структуре интермедиатов.
>Ну я тебе подберу хороший кристалл 3х3х4 мкм под микроскопом. Сделаешь с него рентген?
Нет, лол, нахуя мне лишние соавторы? Два грамма для рентгена тем не менее слишком много. 100 миллиграмм более чем достаточно.
>Последнее, о чем я подумаю для получения граммовых количеств - это ТСХ. Для этой цели делается ТСХ, потом с таким же растворителем и аналогичным адсорбентом делается колонка, где ты точно знаешь Rf целевого вещества.
Ну охуеть. Делаю я значит пластину на силуфоле с эфиром, все заебись разъезжается. Заношу на колонку с силикагелем, лью эфир - всё едет сплошным фронтом. Колонка и ТСХ - разные вещи и логика одного к другому неприменима.
>Назови мне инструмент, который лучше справится с ситуацией.
Подбор условий для проведения реакции селективно. Это сделать проще, чем дрочиться со смесями.
>>411123
А почему бы собственно и нет? ГЖХ работает не со всеми веществами, а ТСХ не несет никакой информации о структуре вещества.
>А если не знаешь, то делаешь ТСХ, а по ней уже смотришь варианты для колонок.
Это все конечно хорошо, но на практике разделение на пластине и на колонке с одним сорбентом и одним растворителем дохуя сильно различается.
>Что ты увидишь после колонки? Будешь каждую каплю в отдельную баночку складывать?
Зависит от вещества. Если окрашено - заебись, собираешь окрашенные полосы, не окрашено - ГЖХ, ТСХ. И да, объединять похожие по ТСХ фракции и тащить на ЯМР. Сорбенты для колонок тоже бывают с индикатором, чтобы можно было лампой светить.
>Но делаются они не после ВЭЖХ/ГХ, в большинстве случаев
Ну естественно, не у каждого же ВЭЖХ стоит.
>по ЯМР некоторые умудряются определять чистоту полученного вещества
Быгыгы, недавно как раз такое было. Притаскивает девочка вещество - черная жижа, а должно быть белыми кристаллами. По ЯМР чистое, убеждает меня. В хроматограф закалываю - лезут два пика одинаковой интенсивности. Вот тебе и чистота по ЯМР.
>Очень важная сфера применения ТСХ - это анализ промежуточных продуктов
Это касается только известных вещей. Если продукты и интермедиаты неизвестны - ТСХ не скажет ничего, кроме количества компонентов в смеси и какого из них больше. А вот по ЯМР уже можно что-то сказать о составе смеси и структуре интермедиатов.
>Ну я тебе подберу хороший кристалл 3х3х4 мкм под микроскопом. Сделаешь с него рентген?
Нет, лол, нахуя мне лишние соавторы? Два грамма для рентгена тем не менее слишком много. 100 миллиграмм более чем достаточно.
>Последнее, о чем я подумаю для получения граммовых количеств - это ТСХ. Для этой цели делается ТСХ, потом с таким же растворителем и аналогичным адсорбентом делается колонка, где ты точно знаешь Rf целевого вещества.
Ну охуеть. Делаю я значит пластину на силуфоле с эфиром, все заебись разъезжается. Заношу на колонку с силикагелем, лью эфир - всё едет сплошным фронтом. Колонка и ТСХ - разные вещи и логика одного к другому неприменима.
>Назови мне инструмент, который лучше справится с ситуацией.
Подбор условий для проведения реакции селективно. Это сделать проще, чем дрочиться со смесями.
>>411123
А почему бы собственно и нет? ГЖХ работает не со всеми веществами, а ТСХ не несет никакой информации о структуре вещества.
Нет конечно. Выкинь свой мускатный орех в помойку и купи водки.
>Да вот ещё читал, что МО вместе с алкоголем - большой для печени вред
Ты блять зожник что ли? Упарывать он собрался, и о печени вдруг забеспокоился. Читай как химку делают и собирай летом траву. Покупаешь силикагеля и гексана, упариваешь это химозное говно и ебашишь флеш-хроматографию химки с гексаном. Я даже патент такой видел, иранский кажется.
>Нет конечно
>Выкинь
>водки
Братюнь, если бы хотел я водки, я бы купил водки. А у меня есть полкило этих орехов, и если ничего с ними не делать, то уже через полгода они станут более суховатыми, значит часть масел уже начнёт испаряться, а спустя ещё полгода они просто загниют, проверено неоднократно.
Поэтому тебе никто и не хочет помогать. Никому не надо сидеть разбираться в действующих веществах этих орехов, в чем они растворяются, как их выделить, только ради того чтобы какой-то днищенарк, который не может найти ничего приличнее, мог один раз упороться. Тем более что
>Понимаю, что занимаюсь хуйнёй, но у меня этого дрянья полкило, а жрать его я уже заебался
Хочешь заниматься хуйнёй - занимайся ей сам.
Ок.
>на практике разделение на пластине и на колонке с одним сорбентом и одним растворителем дохуя сильно различается.
Смотря что такое "сильно". Для меня сильно - это где-то ΔRf=0.2-0.3, и такое у меня получалось только если менять состав подвижной фазы или состав поглощенного неподвижной фазой вещества (в ТСХ в силикагеле вода, а колонку сначала промываешь).
>Сорбенты для колонок тоже бывают с индикатором, чтобы можно было лампой светить.
Я только сейчас понял, зачем нужны колонки из кварца.
>Если продукты и интермедиаты неизвестны - ТСХ не скажет ничего
>по ЯМР уже можно что-то сказать о составе смеси и структуре интермедиатов
Здрасти. Активные группы, полярность вещества - все это показывает ТСХ. Вот как по ЯМР определить, что с чем и у чего связано, не зная веществ - это для меня загадка.
>100 миллиграмм более чем достаточно.
Ну препаративная ТСХ 20х20х0.25 может за один проход столько дать на хорошо делящихся.
>Делаю я значит пластину на силуфоле с эфиром, все заебись разъезжается. Заношу на колонку с силикагелем, лью эфир - всё едет сплошным фронтом
Если на ТСХ был разделительная хроматография вода-эфир, а на колонке пошла адсорбционная эфир-силикагель, то вот, собственно, тебе и причина. Описываемого тобой не должно происходить.
В ВЭЖХ по этой причине вообще отказались от чистого силикагеля, и используют обращенную фазу.
>Вот как по ЯМР определить, что с чем и у чего связано, не зная веществ - это для меня загадка.
Исходные в любом случае известны. КССВ, тонкая структура, хим. сдвиги, двумерки, кози, нози и прочее. Там овер дохуя техник, позволяющих установить и подтвердить структуру.
>Ну препаративная ТСХ 20х20х0.25 может за один проход столько дать на хорошо делящихся.
Нет, это слишком много, полосы будут толстые и широкие. Больше 30 мг на пластину лучше не наносить по моему опыту.
>Если на ТСХ был разделительная хроматография вода-эфир, а на колонке пошла адсорбционная эфир-силикагель, то вот, собственно, тебе и причина. Описываемого тобой не должно происходить.
На силикагеле для колонок тоже есть вода, и в эфире есть вода.
>Описываемого тобой не должно происходить.
Факты вещь трудно опровергаемая.
Установить и подтвердить структуру смеси? Ты ничего сейчас не перепутал, да?
>Нет, это слишком много, полосы будут толстые и широкие
20 см, 2.5 мм слой, 10 мкм среднее зерно, 60Å поры? На 10 мг уже будут полосы узенькие-приузенькие.
>На силикагеле для колонок тоже есть вода, и в эфире есть вода.
>>Описываемого тобой не должно происходить.
>Факты вещь трудно опровергаемая.
У меня не раз сгорал пердак от невоспроизводимости при, казалось бы, тех же условиях. Правда, я не в курсе, чего кладут поехавшие из сорбфила в свои пластины - силиказоль в качестве связующего здесь может оказать медвежью услугу, в том числе изменяя кол-во поглощенной воды, гипс в этом плане инертнее будет.
По ямр если наснимать кози нози и HMQS то можно очень много определить. Белки из 20-30 аминокислот определяются довольно муторно, но определяются. Это как большой японский кроссворд. Но двумерки снимать долго, особенно с углеродниками.
желательно неорганику.
Органику хуйня легкая

Гуголь выдал только форум на этот вопрос, но там толком ничего не ответили.
Вот статья про солевую батарейку.
https://ru.wikipedia.org/wiki/Марганцево-цинковый_элемент
Я понимаю, что цинковый стакан растворяется в в растворе нашатыря, приобретая отрицательный заряд. Тем временем в электролите плавают положительные H3O+ Вопрос: почему они не притягиваются к отрицательному цинковому стакану и не выделяются на нем?
>методику СФМ для определения хлорамфеникола
Как я понимаю, СФМ предполагает использование иммунохимии для непосредственного определения, а подготовка и общие положения описываются в гостах, вот для молока, например: ГОСТ Р 52842-2007 . Если госта для мази нету, то его нету.
Посты жопой читаешь?

У тебя плюс то где будет? На катоде или на аноде? Это не электролитическая ячейка, а гальванический элемент, поэтому меняй знаки на катоде-аноде.
Во-первых, в солевом элементе меди вообще нет. Она есть в элементе Даниэля-Якоби. Во-вторых, плюс на катоде. Но вопрос не об этом. Объясните простым языком: почему положительно заряженные H3O+ не притягиваются к аноду (цинковому стакану)?
Учебник Кутепова-Бондаревой-Беренгартен нормальный?
Где-нибудь лежит полный пак видосов от Роснефти, или кроме этого ничего нет больше? https://www.youtube.com/channel/UC0zBYAmNHStmfk4CnYfGhUw/videos
Притягиваются. Но не восстанавливаются. Для этого надо будет читать термодинамику, а потом электрохимию.
Блин,вот просто задачки по химии формулы я помню,а вот на предыдущем месте учебы Высший матан я полностью завалил
Ок, спасибо. Достаточно.
Тебе повезло, специалист по ацетилену в тхреде. Варианты очистки ацетилена из баллона от воды: пропускаешь последовательно через емкость с олеумом или с прокаленными ситами, потом от ацетона через охлаждаемую до -45 ловушку с активированным углем или оксидом алюминия. От кислорода: щелочной раствор гидросульфита натрия с добавкой антрахинон-β-сульфокислоты.
Если воняет фосфином - дополнительно через окислительную систему (5:1:1 по объему) 30% р-ров СuCl2, FeCl3 и HCl.
>>411563
Эй, специалисты по ацетилену, как вы до сих пор остались с руками-ногами-головой? Я считаю, что вопрос "как очистить ацетилен?" несовместим с инстинктом выживания. Либо ты все и так знаешь, либо ты суицидник, который, наверное, об этом даже не подозревает.
>пропускаешь последовательно через емкость с олеумом или с прокаленными ситами
Что за сита? Ниче что критический диаметр ацетилена 2.8 Å против 3.2 у воды?
>щелочной раствор гидросульфита натрия
Это называется "сульфит натрия".
>через окислительную систему (5:1:1 по объему) 30% р-ров СuCl2, FeCl3 и HCl.
Ты забыл упомянуть, как потом это от HCl чистить.
Сита 3А или 4А, для быстрой осушки ацетилена вместе с охлаждаемой склянкой подходит замечательно.
>Ты забыл упомянуть, как потом это от HCl чистить.
Склянка со щелочью на выходе - это само собой разумеющееся.
Зачем сита? Силикагель же ж. Или может кальция хлорид. Типа что сита не поглощают ацетон? Ололо, в чем их смысл? Они же еще и наглотаются ацетилена, потом эту шнягу будет опасно регенерировать. У цеолита профиль поглощения типичного хорошего осушителя, но даже CaO лучше сушит, чем он.
>Эй, специалисты по ацетилену, как вы до сих пор остались с руками-ногами-головой?
Новогодняя хлопушка/средство подачи звуковых сигналов на случай если заблудился в лесу и уже нет сил аукать: у цельнотянутого аэрозольного баллончика отпиливается верх и сверлится 1-2 мм отверстие в дне. Внутрь кладётся кусочек карбида и 1 небольшой плевок. Встряхивается 10 секунд. Держится в правой руке, левой поджигается спичкой со стороны дна.
После микровзрыва баллончик остаётся чуть тёплым, в лесу слышно за километры.
рождённый в ссср
1 маленький кусочек карбида и 1 небольшой плевок.
Может они не жрут воду из воздуха?
>Но не вижу такого вещества.
Есть NaAlO2, но он получается при сплавлении Al2O3 с Na2O, Na2CO3 или NaOH.
Ну хз, я щас под ним и мне вполне норм, это не тупая трава, от которой просто либо тупишь либо ржёшь (и не надо мне писать, что я нормальную не пробовал, разную я курил), и не всякая дрянь типа фена, под мускат можно и позалипать (в хорошем смысле) и творчеством заняться, тянет под ним такое, хочется что-нибудь по изучать. И стоит он копейки, мне знакомому пришёл свежий из Индии килограмм за 2.5к, в килограмме 200 орехов, конкретно меня сейчас накрыло после варки четырёх орехов в турке вместе с кофе. Да и легален он.
Алсо, надо бы попробовать в молоке/сливках его проварить. Короче, нахуй эту экстрацию спиртягой или ещё чем, так тоже норм.
https://www.youtube.com/watch?v=WlY9kvzxbF4
В кофемолке перетри его, и спиртом потом и вымой
и сольёшь потом спирт в перетёртый перец для настойки.
Спирт отгонишь перегонкой. Этанол или изопропанол.
Алсо, капсаицин растворяется в жирах. Но кофемолку запачкаешь.
Наверняка - омыленим. Капсаицин уйдёт в раствор глицерина, потому что глицерин - спирт, соли жирных кислот не растворяют капсаицин. При этом глицерин смешивается с водой в любых пропорциях, как и мыло, но капсаицин в воде не растворяется.
Таким образом, вымывая мыло и глицерин водой и снижая их концентрацию - можно было бы осадить чистый капсаицин в виде кристаллов из водного их раствора.
>как выделить капсиацин из масла
Только не масла, а жиров. Если ты будешь юзать нефтяные масла,
например моторное или минеральное масло, тут омыление не прокатит.
Алсо, для омыления нужна щелочь, капсаицин вроде как не реагирует с щелочами,
и не растворяется в щелочах.
>Только не масла, а жиров.
Имелось ввиду эфирное масло полученное из натур сырья. Омыление наверное единственный вариант.
Ты чё омыление содой делал? Гидрокарбонат натрия да, даёт щелочную реакцию среды.
Но, получил бы едкий натр электролизом хлорида натрия.
А что касается маслянистой хуиты - это может быть капсаицин в глицерине,
ибо глицерин C3H5(OH)3 - представляет собой вязкую прозрачную жидкость.
А поскольку у тебя пищевая сода, можешь её прокалить в кальцинированную:
2NaHCO3 = Na2CO3 + CO2 + H2O
И известняк заодно прокалить: СаСО3 = СaO + CO2
Негашёнку погасить: СaO + H2O = Ca(OH)2
И свежегашённую известь: с концентрированным раствором кальцинированной соды - прокипятить.
Na2CO3 + Са(ОН)2= СаСО3↓ + NaOH
Ну или перегретым паром из соли щелочь получить:
(500°С) 2NaCl + H2Oпар = 2NaOH + HCl↑ (с его выветриванием)

Капсиацин сам по себе жирная кислота, такие вот дела. Те он как бы правильно выпал в осадок и дальше размазался по бумажному фильтру.
На ум приходит только попробовать его выбить бензином или эфиром типа галоши из раствора воды и мыла.
Почму дегидратация этилового спирта идёт только под концентрированной серной кислотой? Это вообще можно объяснить на школьном уровне? Почему вообще механизмы протеканий реакций такие? Ничего не понятно. Даётся просто как факт, без какого-либо доказательства. Школьная программа подразумевает банальную зубрёжку механизмов протеканий реакций? Ебанатство какое-то. Наверняка я просто не понимаю суть химии, не может же так быть.

>Капсиацин сам по себе жирная кислота
Это тебе так мамка сказала?
Капсаицин (ванилиламид 8-метил-6-ноненовой кислоты).
В жестких условиях гидролизуется, давая ванилиламин и 8-метил-6-ноненовую кислоту.
Чистый капсаицин представляет собой бесцветное кристаллическое вещество со жгучим вкусом.
При омылении, помимо мыла - образуется также глицерин, т. к. жиры - это триглицериды жирных кислот.
Пикрелейтед. Глицерин - это трехатомный спирт, и вполне возможно что он растворяет капсаицин.
К тому же маслянистая хуета вполне может быть обусловлена вязкостью глицерина.
Глицерин - с водой смешивается, так что убрав мыло, и слив эту хуету свою маслянистую,
попробуй смешать её с водой и как-бы, походу, жди кристаллов. Лично я х3 что будет, ибо такой хуйнёй не страдал ещё.
>>412313
На английской версии больше жёлтых элементов внизу.
http://periodictable.ru/index_en.html
Алсо, вот: https://ru.wikipedia.org/wiki/Расширенная_периодическая_таблица_элементов
Тут даже Унбигексий есть.
>Даётся просто как факт, без какого-либо доказательства
Да.
>Школьная программа подразумевает банальную зубрёжку механизмов протеканий реакций?
Да.
Спасибо за ответ. Пошло оно всё нахуй.
>Почему например реакция получения этаналя из ацетилена с водой идёт только под Hg?
Там промежуточное соединение образуется.
Получают уксусный альдегид гидратацией ацетилена в присутствии солей ртути (реакция Кучерова),
с образованием енола, который изомеризуется в альдегид.
Присоединение воды к молекуле алкина протекает по правилу Марковникова.
Ион Hg2+ образует π-комплекс с молекулой алкина, к которой присоединяется молекула воды
с промежуточным образованием нестойкого енола, изомеризующегося в карбонильное соединение - альдегид.
>Почму дегидратация этилового спирта идёт только под концентрированной серной кислотой?
Потому что концентрированная серная кислота - водоотнимающее вещество.
Алсо как вариант может быть ещё оксид фосфора.
Самым гигроскопичным веществом является оксид фосфора (V), но он даёт фосфорную кислоту,
и может быть реакция фосфорилирования органических веществ.
Поэтому концентрированная серная кислота лучше.
Всё остальное - хуита. У тебя же гугл есть. Взял и проверил, и углубился там ещё.
К слову о
>Почему например реакция получения этаналя из ацетилена с водой идёт только под Hg?
ответ: потому что это не так
https://doi.org/10.1016/j.tet.2015.03.034
https://doi.org/10.1016/j.tetlet.2013.06.015
https://doi.org/10.1016/j.catcom.2015.03.003
Мы - два разных анону, но это не важно.
Я из треда в тред учу-учу вас, а вы необучаемые: задача образования - научить человека бездумно выполнять инструкции, какими бы безсмыслеными они не были, и даже более того, панически бояться сомнения и поиска, то есть "не знаю, давайте разберемся".
Школьные знания не должны быть актуальными, и даже лучше если они не соответствуют реальности - это очень соответствует духу виртуальной школьной реальности со своими виртуальными успехами и поражениями.
Но ведь подобная мельтешня только сжирает драгоценные энергоресурсы...
Если ДС, то можешь стать технологом:
Российский химико-технологический университет им. Д. И. Менделеева (РХТУ),
Московская государственная академия тонкой химической технологии им. М. В. Ломоносова,
Московский государственный открытый университет.
Алсо, пиздуй в BASF, если там нужны технологи, может и обучат тебя там.
Как к физике относишься? А вообще химия на 90% далека от биологии, не знаю почему ты её в такую тупую пару поставил. В школах тоже дауны ставят химбио, банально из-за спроса на меды.
>Лично я х3 что будет, ибо такой хуйнёй не страдал ещё.
Все с тобой ясно, спасибо за участие.
Советую Неорганическую химию под редакцией Третьякова. там 3 тома.
И современный курс общей химии Хаускрофта.
Краткий справочник химика. Любой.
Ты реально думаешь что книга "не для химиков" мне вообще была бы интересна? Толсто троллишь, это реально говнище а не книга, с кучей неточностей. По сравнению с Гринвудом, это как сказка о курочке Рябе, и преступление и наказание.
Ну если ты читал то можешь конкретно написать почему она говно. А так я вижу лишь визгливые кукареки.
>>412526
Пролистал быстренько, первая часть норм, но похожа на трейлер. Вводить молекулярные орбитали на 2 страницы и потом про них благополучно забывать, хотя любой человек который ничего про них не знает, не уловит что это такое. Скорее поймет что они есть, а как их строить вообще не поймет, и почему у них такие энергии тем-более. То же самое к термодинамике относится, за 2-3 страницы пытается отхватить термодинамику, хотя на это надо в идеале целую книгу(ну или страниц 50, если лайт версия), та же штука с любым теоретическим материалом с первой части, хуево. Так как по каждой этой теме в идеале прочитать отдельную книгу, ну или хотя бы Третьякова первый том, там по 20 страниц хотя бы уделяют в виде лайт версии с задачами на каждую тему. Про химическую часть скажу то же самое, там просто какие-то основные очевидные реакции, ладно даже пусть они там будут, но их мало, очень опять как трейлер, и никаких ссылок на статьи, вообще.
А человек просил вникнуть [плотно/b] поэтому не советую.
По существу ответишь? Или мне нельзя читать книгу очень быстро? И надо вчитываться, как меня учат 2Х2?

1.Ты ёе не читал, а пролистал, и если ты не видишь разницы то у тебя проблемы.
2.Если аноним хочет вникнуть в химию и спрашивает С ЧЕГО НАЧАТЬ а начина надо с общей химии, глинка это книга по которой раньше учили и которая на текущий момент факультативная литература. Она актуальна и используема. В отличии от того что посоветовал ты.
3.Ты уже заебал, даун ебаный, со своим "не читал но осуждаю". Общаясь мы ирл я бы тебе уже дал по ебалу этой книгой.
Скажи пожалуйста, сколько тебе ушло бы времени посмотреть что написано в книге "математика 4 класс"? Минут 5? ты бы посмотрел оглавление, пролистал бы основные темы, увидел бы классические объяснения, увидел бы, что нет чего-то важного, и всё. Я лишь использовал слово "пролистал", так как прочитал быстро, и не вчитывался в каждое слово, важна была структура, нового там ничего не написано. Или чтобы судить тебе пришлось бы читать весь блять учебник? Если хочешь плотно начать учить, то начинать надо с нормальных учебников, где хотя бы лайт-версия информации, а не ебаный пробник "термодинамики" пробник "химии элементов" и т.д. Он его прочитает узнает много нового, но нихуя не поймет. Я посоветовал те учебники, с которых я начал учить химию в 8 классе. А я очень быстро в ней освоился, и довольно нихуево. Только потому, что взял сразу нормальный учебник. Как я понял ты не химик? (технолог тоже не считается) Ты вообще в курсе как должна работать теоретическая часть? Она должна быть последовательна, связна, и не высасывать из пальца формулы, в стиле "ну вот это у нас орбитали, ой ладно, у нас страницы на эту главу заканчиваются, так что жри следующую тему".
Напишу на понятном тебе языке - иди нахуй, даун ебаный вместе со своим даунским мнением. Так понятно?
А ты уверен, что это не просто декоративная формула, ну или фотка не обрезана? У кислорода валентность равна двум, а у того верхнего закрыта только одна.
Это хуй.
Похоже на ресвератрол. Только перевёрнутое, и там кислород. Ресвератрол - в треде про биологическое бессмертие предыдущем...
>>412551
Давайте я вас разсужу: авторы подобных книг не знают всех тем, которые они описывают, информацию черпают в лучшем случае из третьих рук, в лучшем случае создавая у читающего илюзию понимания темы, в худшем случае вызывая приступ батхерта типа "я нихуя не понял" или "как это все можно запомнить?". Практически это примерно как читать хорошо сделаный конспект отличницы. По сути, основная задача таких книг - это дать определения, чтобы будущий раб мог понимать приказы и инструкции. Поскольку изучать определения совсем уж в отрыве от понимания темы - крайне неэфективно, потому читающим дают некоторую илюзию понимания темы, как вехи к которым можно цеплять определения.
Изначально речь шла про
>>412432
>Очень сильно хочу вникнуть в химию, прям плотно (не с целью получения образования, а для себя)
а глинка - это книга для того, чтобы получить зачет.

Ладно, поскольку глинка - это довольно популярная книга, то мне придется ее обосрать.
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений
Итак, книга начинается с того, что все учителя пропускают "Глава I. Атомно-молекулярное учение", с темы, которая новичку не понятна, и даже непонятно зачем ее понимать. История, алхимики, превращшения вещества, развитие теории, закона сохранения массы (ну охуеть, какое важное для меня знание), даже ебаного эйнштейна впиндюрили, надо же какие молодцы. Закон Авогадро, молекулярные массы - ну охуеть вообще, это то, что мечтает узнать человек, который не знает о химии ничего. Нас в школе и институте тоже возили по молекулярным масам и молярному объему, и один хуй люди с трудом понимают, зачем это и почему.
В реальности простому пиздюку все что нужно знать - это что вещества состоят из отдельных частиц, каждая частица имеет разный вес, что железо тяжелее воды, потому что атомы железа тяжелее атомов воды. Расчеты должны быть связаны с практической работой, для которой они и предназначены как бы, а ее тут и нет.
Валентности я ебал в рот, потому что это уебищное устаревшее понятие. Например, у Hg2Cl2 валентность ртути - два. Понятие валентности нужно для расчета состава вещества, но в реальности здесь решает только тупое запоминание, где там NaHSO4, где NaHSO5, а где NaHSO3.
Дальше идет все привычным нам поток определений, не привязаных ни к каким-то задачам и вообще непонятно зачем нужных: rислоты, щелочи, гидроксилы, солеобразующие, амфотерные, ну и самое вкусное - химические расчеты. Химические расчеты, которые всегда являются следствием практики и точны настолько, насколько близки к практике. Которой тут и не пахнет.
Глава II. Периодический закон менделеева. Здесь можно было бы приводить эксперименты реакции йода с хлором, потом лития-натрия-калия гидроксидов, которые обладают удивительно похожими свойствами, и сказать, что систематизация похожести свойств сделана в форме таблички, но требования к уебищности описания вынудили автора щедро приправить тему определениями и безсмыслеными подробностями. Что характерно - даже в школе училка не могла нам внятно объяснить, почему у хлора атомная маса 35.5.
"Глава III. Строение атома" - это хуйня, которая школьнику не нужна и никто ее не запомнит. Радиоактивность, спектры, квантовая теория спектра, строение атома по Бору, волновая функция, орбитальное квантовое число - это тема, которая кроме того что сложна, так еще и не изучена до конца. Заполнение электроных оболочек атомов - это охуительнейше сложная тема, которая даже мне спустя многие годы трудна и неясна. Например, у кислорода в составе O2 есть не меньше трех вариантов заполнения оболочки, с разной реактивностью молекулы. Никто не знает, почему кол-во пар электронов в периоде n равно n^2. Это все - абсолютно неподъемная тема для студента нехимической специальности. Почему электроны в соответствии с законом Хунда из 3p не упиздовывают на 3d - это тоже загадка, которая для студня непосильна. Ему остается лишь искать какие-то божественые знаки и придумывать пророчества, чем они потом нередко занимаются и на своем рабочем месте, потому что больше нихуя не умеют. Я невольно начинаю понимать, откуда эта ебанутость берется в людях, с которыми я общаюсь.
Радиоактивный распад, ядерные реакции - охуительная история.
Сто страниц отборного говна пройдено. Идем дальше.
Глава IV. Химическая связь и строение молекул. Я хочу здесь подчеркнуть, что нарисованое автором строение молекул неправильно, а фосфорноватистая кислота имеет два таумера с разными хим свойствами.
Метод "восемь точечек вокруг атома" - это довольно мощное средство, но даже его автор умудрился испоганить безсмыслеными подробностями.
неполярная и полярная ковалентная связь. Меня реально доебало то, как автор умудряется по сути простую информацию запихивать в такую уебищную форму, что она становится малопонятной. Он начинает забуриваться в диполи, дипольные моменты, хотя этот же автор, бля буду, не сможет объяснить, почему хлороформ, имеющий близкий к воде дипольный момент и константу кислотной дисоциации, нерастворим в воде.
Ковалентная связь, гибридизация - просто идите нахуй. У меня есть устойчивое впечатление, что цель книги - показать изучающему, как все это сложно и неподъемно для него.
Ионая связь. Наиболее низкоэнергетическое состояние атома - когда у него n^2 электронов, то есть, электроная оболочная инертного газа. Атомы первой-второй групы имеют n^2+1 и n^2+2 электронов, потому склоны отдавать 1-2 электрона, а галогены - наоборот, легко забирают один электрон. Куда проебался этот разсказ - не знаю.
Глава V. Строение твердого тела и жидкости. Начало в том же духе: статические диполи, индуцированые диполи, формы кристалов, рентгенография, дефекты структуры, амфорные вещества. Я думаю, что для выдерживания градуса мудацтва в последующих изданиях все-таки добавили сюда еще и жидкие кристалы.
Глава VI. Основные закономерности протекания химических реакций. Термохимические расчеты имеют применение только при наличии цифр по конкретным исходным и конечным состояниям веществ. Разные кристалы, жидкое-твердое-газообразное состояние, разные растворители приводят к изменению энергии образования. На самом деле здесь идея очень простая - это закон сохранения энергии: энергия ни откуда не берется и никуда не исчезает. Кило водорода при реакции с кислородом выдает одно и то же кол-во тепла независимо от промежуточных состояний.
Скорость химической реакции, гетерогеные и гомогеные реакции - только в каких-то исключительных условиях удается добиться точного исполнения законов. В остальных случаях имеет место смешаные закономерности с нецелыми степенями у концентраций.
Зависимость скорости реакции от температуры - приводится нормальное распределение, но автор почему-то умудляется забыть о том, что на высоких температурах скорость реакции перестает увеличиваться, хотя у него под носом графики, которые это показывают.
Катализаторы. Фотореакции. Необратимые и обратимые реакции. Тупо определения. Автор сравнивает условно необратимую реакцию с условно обратимой. Достаточно для сдачи зачета. Я прикладываю пик.
Смещение химического равновесия. Одна из ключевых тем химии, на самом деле, но автор традиционо подходит к ней со стороны жопы. Первые два абзаца достаточно исчерпывающе опиывают весь вопрос. В том же духе автор хуярит кучу формул, какие-то примеры с неясным приложением.
Дальше термодинамика, энтальпия, эмпирические формулы расчета равновесия по энергиям - все это нахуй не нужно и не добавляет понимания предмета, и служит исключительно для отбора дебилов, которым похую что отвечать на экзамене, пока адекватные люди смотрят на эту всю хуйню и думают что-то вроде "бля, как оно все работает?". Помнится, примерно так я вслух и матюкнулся прям на лекции, поскольку был одним из немногих, кто реально пытался понять, что написано на доске, а не просто конспектировать или болтать с соседом.

Ладно, поскольку глинка - это довольно популярная книга, то мне придется ее обосрать.
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений
Итак, книга начинается с того, что все учителя пропускают "Глава I. Атомно-молекулярное учение", с темы, которая новичку не понятна, и даже непонятно зачем ее понимать. История, алхимики, превращшения вещества, развитие теории, закона сохранения массы (ну охуеть, какое важное для меня знание), даже ебаного эйнштейна впиндюрили, надо же какие молодцы. Закон Авогадро, молекулярные массы - ну охуеть вообще, это то, что мечтает узнать человек, который не знает о химии ничего. Нас в школе и институте тоже возили по молекулярным масам и молярному объему, и один хуй люди с трудом понимают, зачем это и почему.
В реальности простому пиздюку все что нужно знать - это что вещества состоят из отдельных частиц, каждая частица имеет разный вес, что железо тяжелее воды, потому что атомы железа тяжелее атомов воды. Расчеты должны быть связаны с практической работой, для которой они и предназначены как бы, а ее тут и нет.
Валентности я ебал в рот, потому что это уебищное устаревшее понятие. Например, у Hg2Cl2 валентность ртути - два. Понятие валентности нужно для расчета состава вещества, но в реальности здесь решает только тупое запоминание, где там NaHSO4, где NaHSO5, а где NaHSO3.
Дальше идет все привычным нам поток определений, не привязаных ни к каким-то задачам и вообще непонятно зачем нужных: rислоты, щелочи, гидроксилы, солеобразующие, амфотерные, ну и самое вкусное - химические расчеты. Химические расчеты, которые всегда являются следствием практики и точны настолько, насколько близки к практике. Которой тут и не пахнет.
Глава II. Периодический закон менделеева. Здесь можно было бы приводить эксперименты реакции йода с хлором, потом лития-натрия-калия гидроксидов, которые обладают удивительно похожими свойствами, и сказать, что систематизация похожести свойств сделана в форме таблички, но требования к уебищности описания вынудили автора щедро приправить тему определениями и безсмыслеными подробностями. Что характерно - даже в школе училка не могла нам внятно объяснить, почему у хлора атомная маса 35.5.
"Глава III. Строение атома" - это хуйня, которая школьнику не нужна и никто ее не запомнит. Радиоактивность, спектры, квантовая теория спектра, строение атома по Бору, волновая функция, орбитальное квантовое число - это тема, которая кроме того что сложна, так еще и не изучена до конца. Заполнение электроных оболочек атомов - это охуительнейше сложная тема, которая даже мне спустя многие годы трудна и неясна. Например, у кислорода в составе O2 есть не меньше трех вариантов заполнения оболочки, с разной реактивностью молекулы. Никто не знает, почему кол-во пар электронов в периоде n равно n^2. Это все - абсолютно неподъемная тема для студента нехимической специальности. Почему электроны в соответствии с законом Хунда из 3p не упиздовывают на 3d - это тоже загадка, которая для студня непосильна. Ему остается лишь искать какие-то божественые знаки и придумывать пророчества, чем они потом нередко занимаются и на своем рабочем месте, потому что больше нихуя не умеют. Я невольно начинаю понимать, откуда эта ебанутость берется в людях, с которыми я общаюсь.
Радиоактивный распад, ядерные реакции - охуительная история.
Сто страниц отборного говна пройдено. Идем дальше.
Глава IV. Химическая связь и строение молекул. Я хочу здесь подчеркнуть, что нарисованое автором строение молекул неправильно, а фосфорноватистая кислота имеет два таумера с разными хим свойствами.
Метод "восемь точечек вокруг атома" - это довольно мощное средство, но даже его автор умудрился испоганить безсмыслеными подробностями.
неполярная и полярная ковалентная связь. Меня реально доебало то, как автор умудряется по сути простую информацию запихивать в такую уебищную форму, что она становится малопонятной. Он начинает забуриваться в диполи, дипольные моменты, хотя этот же автор, бля буду, не сможет объяснить, почему хлороформ, имеющий близкий к воде дипольный момент и константу кислотной дисоциации, нерастворим в воде.
Ковалентная связь, гибридизация - просто идите нахуй. У меня есть устойчивое впечатление, что цель книги - показать изучающему, как все это сложно и неподъемно для него.
Ионая связь. Наиболее низкоэнергетическое состояние атома - когда у него n^2 электронов, то есть, электроная оболочная инертного газа. Атомы первой-второй групы имеют n^2+1 и n^2+2 электронов, потому склоны отдавать 1-2 электрона, а галогены - наоборот, легко забирают один электрон. Куда проебался этот разсказ - не знаю.
Глава V. Строение твердого тела и жидкости. Начало в том же духе: статические диполи, индуцированые диполи, формы кристалов, рентгенография, дефекты структуры, амфорные вещества. Я думаю, что для выдерживания градуса мудацтва в последующих изданиях все-таки добавили сюда еще и жидкие кристалы.
Глава VI. Основные закономерности протекания химических реакций. Термохимические расчеты имеют применение только при наличии цифр по конкретным исходным и конечным состояниям веществ. Разные кристалы, жидкое-твердое-газообразное состояние, разные растворители приводят к изменению энергии образования. На самом деле здесь идея очень простая - это закон сохранения энергии: энергия ни откуда не берется и никуда не исчезает. Кило водорода при реакции с кислородом выдает одно и то же кол-во тепла независимо от промежуточных состояний.
Скорость химической реакции, гетерогеные и гомогеные реакции - только в каких-то исключительных условиях удается добиться точного исполнения законов. В остальных случаях имеет место смешаные закономерности с нецелыми степенями у концентраций.
Зависимость скорости реакции от температуры - приводится нормальное распределение, но автор почему-то умудляется забыть о том, что на высоких температурах скорость реакции перестает увеличиваться, хотя у него под носом графики, которые это показывают.
Катализаторы. Фотореакции. Необратимые и обратимые реакции. Тупо определения. Автор сравнивает условно необратимую реакцию с условно обратимой. Достаточно для сдачи зачета. Я прикладываю пик.
Смещение химического равновесия. Одна из ключевых тем химии, на самом деле, но автор традиционо подходит к ней со стороны жопы. Первые два абзаца достаточно исчерпывающе опиывают весь вопрос. В том же духе автор хуярит кучу формул, какие-то примеры с неясным приложением.
Дальше термодинамика, энтальпия, эмпирические формулы расчета равновесия по энергиям - все это нахуй не нужно и не добавляет понимания предмета, и служит исключительно для отбора дебилов, которым похую что отвечать на экзамене, пока адекватные люди смотрят на эту всю хуйню и думают что-то вроде "бля, как оно все работает?". Помнится, примерно так я вслух и матюкнулся прям на лекции, поскольку был одним из немногих, кто реально пытался понять, что написано на доске, а не просто конспектировать или болтать с соседом.
Глава VII. Вода. Растворы. Цитирую:
"Количество примесей в пресных водах обычно лежит в пределах от 0.01 до 0.1 % (масс.). Морская вода содержит 3.5% (масс.) растворенных веществ, главную массу которых составляет хлорид натрия (поваренная соль).
Вода, содержащая значительное количество солей кальция и магния, называется жесткой в отличие от мягкой воды, например дождевой. Жесткая вода дает мало пены с мылом, а на стенках котлов образуется накипь."
Мне так и хочется задать автору вопрос: нахуй ты мне все это пишешь? Ну вот узнал я, что в морской воде хлорид натрия, а не калия - и че дальше? Пидарас даже упомянул тройную точку и критическую температуру. Это справочник или учебник, алеу? Если справочник, то почему информация так небрежно разбросана по тексту?
Автор превзошел себя вот здесь:
"Клатраты используются для разделения углеводородов и благородных газов. В последнее время образование и разрушения клатратов газов )пропана и некоторых других) успешно применяется для обессоливания воды. нагнетая в соленую воду при повышенном давлении соответствующий газ, получают льдоподобные кристаллы клатратов, а соли остаютяс в растворе. Похожу на снег массу кристаллов отделяют от маточного раствора и промывают. затем при некотором повышении температуры или уменьшении давления клатраты разлагаются, образуя пресную воду и исходный газ, который вновь используется для получения клатрата."
где приведена полнейшая хуета из состава научных трудов разлагающегся совка, где в погоне за новизной забыли о здравом смысле, который заключается в том, что даный метод не имеет преимуществ перед тупым вымораживанием воды. Здесь мы видим хороший пример отсутствия критического мышления у автора, очередной, но яркий.
Растворимость. Растворимость газов. Осмос. Почему-то статья википедии https://en.wikipedia.org/wiki/Lower_critical_solution_temperature есть только на английском языке, что показывает уровень развития материаловедения в постсовке.
Давление пара растворов. Замерзание и кипение растворов - охуено важные темы, которая здесь практически не раскрыты. По этой причине, например, в одной американской лабе пизданул диазидометан, потому что тамошнее академическое быдло не сообразило, что при снижении концентрации растворенного легколетучего вещества давление его паров снижается пропорционально, но малое кол-во всегда остается: https://dx.doi.org/10.1021/op8000977 - Diazidomethane Explosion
Все, я заебался, извините. Мне кажется, что расмотерного материала достаточно для того, чтобы показать, кто такой автор и чему он учит читателя, а также почему имено этого человека опубликовали, а более адекватных людей выгнали из института где-то на втором курсе.
Глава VII. Вода. Растворы. Цитирую:
"Количество примесей в пресных водах обычно лежит в пределах от 0.01 до 0.1 % (масс.). Морская вода содержит 3.5% (масс.) растворенных веществ, главную массу которых составляет хлорид натрия (поваренная соль).
Вода, содержащая значительное количество солей кальция и магния, называется жесткой в отличие от мягкой воды, например дождевой. Жесткая вода дает мало пены с мылом, а на стенках котлов образуется накипь."
Мне так и хочется задать автору вопрос: нахуй ты мне все это пишешь? Ну вот узнал я, что в морской воде хлорид натрия, а не калия - и че дальше? Пидарас даже упомянул тройную точку и критическую температуру. Это справочник или учебник, алеу? Если справочник, то почему информация так небрежно разбросана по тексту?
Автор превзошел себя вот здесь:
"Клатраты используются для разделения углеводородов и благородных газов. В последнее время образование и разрушения клатратов газов )пропана и некоторых других) успешно применяется для обессоливания воды. нагнетая в соленую воду при повышенном давлении соответствующий газ, получают льдоподобные кристаллы клатратов, а соли остаютяс в растворе. Похожу на снег массу кристаллов отделяют от маточного раствора и промывают. затем при некотором повышении температуры или уменьшении давления клатраты разлагаются, образуя пресную воду и исходный газ, который вновь используется для получения клатрата."
где приведена полнейшая хуета из состава научных трудов разлагающегся совка, где в погоне за новизной забыли о здравом смысле, который заключается в том, что даный метод не имеет преимуществ перед тупым вымораживанием воды. Здесь мы видим хороший пример отсутствия критического мышления у автора, очередной, но яркий.
Растворимость. Растворимость газов. Осмос. Почему-то статья википедии https://en.wikipedia.org/wiki/Lower_critical_solution_temperature есть только на английском языке, что показывает уровень развития материаловедения в постсовке.
Давление пара растворов. Замерзание и кипение растворов - охуено важные темы, которая здесь практически не раскрыты. По этой причине, например, в одной американской лабе пизданул диазидометан, потому что тамошнее академическое быдло не сообразило, что при снижении концентрации растворенного легколетучего вещества давление его паров снижается пропорционально, но малое кол-во всегда остается: https://dx.doi.org/10.1021/op8000977 - Diazidomethane Explosion
Все, я заебался, извините. Мне кажется, что расмотерного материала достаточно для того, чтобы показать, кто такой автор и чему он учит читателя, а также почему имено этого человека опубликовали, а более адекватных людей выгнали из института где-то на втором курсе.
химию лучше осваивать по книгам выпущенным не позднее 30-х годов 20-го века в германии. лучше на языке оригинала, если есть такая возможность.
там очень хорошо расписаны методы получения веществ и элементов. именно химию как науку о превращениях.
темы, касающиеся всяких орбиталей и прочего квантмеха на начальном этапе когда у него не полностью ОВР в голове есть вообще не нужны. возникнет желание разобраться глубже в механизмах - будет курить отдельно.
>>412598
>по книгам выпущенным не позднее 30-х годов 20-го века в германии. лучше на языке оригинала, если есть такая возможность.
И под правильную музыку, верно?
меня музыка отвлекает от материала в который надо вникнуть.
особенно если это хорошая музыка.
но тут уж каждому своё.
оставайтесь на линии. мнение дегенератов с харкача поклоняющихся глинкам очень важно для меня.
Сам иду на физику больше, но мб и химия нужна будет, так что на нее я не забиваю, просто нужен учебник который поведает мне тайны 10-11 класса, а не будет нагружать мой мозг программой свыше
Похуй, электроны в 2к раз легче протонов
У тебя различие самом тяжелом нынче атоме полученном(118, если не ошибаюсь?) будет в 0.05 а.е.м, дохуя?
тебе в un/
Анон, ты не поверишь, я читал за 1850 год статьи, я был удивлен тому, какие в то время адекватные люди были и насколько много они знали про вещества и их превращения. Заметно больше среднего выпускника хим фака, который знает, что электроотрицательность - это среднее между сродством к электрону и энергией ионизации, но не может получить элементарный бром.
Это удивительно, но сейчас, как и 80 лет назад, химики смешивают реактивы в стекляной посуде, и единственое, что сильно изменилось - это средства анализа. Даже выделение продукта хроматографией является весьма сомнительным способом, и зачастую ему предпочитают традиционую кристализацию-дистиляцию-экстракцию-фильтрование.
>>412683
Мнение чувака, который считает, что школьная олимпиада что-то показывает, конечно же важно.
Слабо решить её хотя бы на 30%? думаю что не сможешь.
Я не про задрипаную городскую, и не про даунскую областную, и даже не про всеросс...надеюсь ты понял намёк.
Я просто читал задания всероса и уже обсирал в этом или прошлом треде ее. Суть в том, что химия - это исключительно практическая отрасль. Уже на уровне области в олимпиадах по физике имеются практические задания, где тебе нужно измерить и оценить точность твоих измерений. Например, силу трения песка при помощи говна и палок. В америке есть практически олимпиады по химии, и все продвинутые рашкинские олимпиадники там будут сидеть с хуем за щекой и круглыми глазами, потому что, внезапно, инфу нужно добывать самому, а не из жопы впереди идущего.
Здесь же даже на межнаре задания уровня "напиши формулу", "нарисуй строение кристала", "посчитай параметры по одной-двум формулам", то есть, предельно прямолинейные задачи. Здесь побеждает тот, кто решит задачи быстрее, а чтобы решать их быстрее - нужно их задрачивать.
В чем заслуга человека, который научился быстро решать однотипные задачи? Я не был на крупных хим олимпиадах, только по программированию, и там у меня возникло то самое ощущение: знаю как решить, но тупо не хватает времени чтобы написать и отладить.
Без пизды, по книжкам вроде глинки к таким олимпиадам готовиться норм, но навыка химических превращений это не добавляет, и в итоге бабуля-лаборант лучше справляется в лабе, чем вася-призер всеросса.
Там 40 процентов это практур(кстати в США, прак скучный был), плюс теория отличается от страны к стране, азиатские олимпиады, это чисто то, что ты описал. Дают 60 листов и сиди решай. СНГ получше подбирают задачи (задач мало, но ядрёные пиздец, обычно пытаются поставить задачи с которыми сталкиваются научные работники в лабах, и там процент решения 60 будет считаться очень хорошим)в азии 95% считается норм. Лично мне досталось на 5 часов, оттитровать два каких-то говна, сделать установку для сбора водорода над водой, чтобы определить константу скорости реакции разложения NH3*BH3 на коллоидном палладии(in situ), и еще провести оргсинтез в две стадии c фероценовым производным, после чего разделить стереопродукт на колонке, и найти выход каждого с помощью спектрофотометра. Как понимаешь, без большой практической подготовки зафейлишь или не успеешь.
Но в любом случае, парень просил именно разобраться, и именно плотно. Изучение химии всегда начинается c теории, с нормальной теории. Ты можешь быть отличным исполнителем методик, но если ты получаешь что-то своё, и принципиально новое, то ты без банальных знаний термодинамики и кинетики, не врубишься какие надо взять условия, почему такие побочки, как направить кинетику, и можно ли её вообще направить. Будешь сидеть и перебирать варианты как дятел, а окажется что в теории это вообще невозможно при 1 атм.
Я хоть сейчас и убежал работать в физхим и теорию, но очень тепло отношусь к химикам практикам. Прикладная химия - это именно "чистая химия", да она прикладная, да она не фундаментальная, но это именно та самая химия с чего всё начиналось. Но начинать сразу с практики, без основ теории, это просто нерационально. Ведь если сделать это в другом порядке, то помимо навыков будет еще и осмысление того что ты делаешь руками. Если же на что-то закрывать глаза, то будет пиздец, который потом придется исправлять, а это сложнее. Большинство школьников мне отвечают что электроны вращаются вокруг ядра. Я не знаю чему их там учат, но хочется уебать создателям школьного учебника. На одном предмете им говорят что заряд излучает поле при вращении, а на другом что электрон вращается вокруг ядра, и всем блять всё норм.
А Глинка это больше справочник.
ненавижу призеров всероса, слишком тупые чтобы еще работать, но думают что могут. Назопоминали всякого говна, и только на этом проползли
Там 40 процентов это практур(кстати в США, прак скучный был), плюс теория отличается от страны к стране, азиатские олимпиады, это чисто то, что ты описал. Дают 60 листов и сиди решай. СНГ получше подбирают задачи (задач мало, но ядрёные пиздец, обычно пытаются поставить задачи с которыми сталкиваются научные работники в лабах, и там процент решения 60 будет считаться очень хорошим)в азии 95% считается норм. Лично мне досталось на 5 часов, оттитровать два каких-то говна, сделать установку для сбора водорода над водой, чтобы определить константу скорости реакции разложения NH3*BH3 на коллоидном палладии(in situ), и еще провести оргсинтез в две стадии c фероценовым производным, после чего разделить стереопродукт на колонке, и найти выход каждого с помощью спектрофотометра. Как понимаешь, без большой практической подготовки зафейлишь или не успеешь.
Но в любом случае, парень просил именно разобраться, и именно плотно. Изучение химии всегда начинается c теории, с нормальной теории. Ты можешь быть отличным исполнителем методик, но если ты получаешь что-то своё, и принципиально новое, то ты без банальных знаний термодинамики и кинетики, не врубишься какие надо взять условия, почему такие побочки, как направить кинетику, и можно ли её вообще направить. Будешь сидеть и перебирать варианты как дятел, а окажется что в теории это вообще невозможно при 1 атм.
Я хоть сейчас и убежал работать в физхим и теорию, но очень тепло отношусь к химикам практикам. Прикладная химия - это именно "чистая химия", да она прикладная, да она не фундаментальная, но это именно та самая химия с чего всё начиналось. Но начинать сразу с практики, без основ теории, это просто нерационально. Ведь если сделать это в другом порядке, то помимо навыков будет еще и осмысление того что ты делаешь руками. Если же на что-то закрывать глаза, то будет пиздец, который потом придется исправлять, а это сложнее. Большинство школьников мне отвечают что электроны вращаются вокруг ядра. Я не знаю чему их там учат, но хочется уебать создателям школьного учебника. На одном предмете им говорят что заряд излучает поле при вращении, а на другом что электрон вращается вокруг ядра, и всем блять всё норм.
А Глинка это больше справочник.
ненавижу призеров всероса, слишком тупые чтобы еще работать, но думают что могут. Назопоминали всякого говна, и только на этом проползли
Описываемые тобой олимпиады мне начинают немного нравится. Но мой опыт по физике говорит о том, что даже на самых высоких уровнях тренировка решает если не все, то почти все - ты должен потренироваться решать тысячи олимпиадных задач, чтобы у тебя новые решения от зубов отскакивали, чтобы для тебя нестандартные. так сказать, задачи стали стандартными, поскольку у тебя есть целый веер инструментов и понимание наиболее перспективных путей решения.
Бля буду, я смогу поставить такие условия, что обосрутся все олимпиадники и будут сидеть днями втыкать в оборудование, чтобы понять, что и почему происходит. А что можно сделать за 3-5 часов? Прямолинейные задания, типа собрать установку для простой реакции и измерить кинетику.
>Изучение химии всегда начинается c теории, с нормальной теории
Не спорю. Глинка - это не нормальная теория. Глинка - это ебаное говнище, наполовину краткий справочник, наполовину лекция обо всем и ни о чем.
>Будешь сидеть и перебирать варианты как дятел, а окажется что в теории это вообще невозможно при 1 атм
Окажется это только после получения экспериментальных сведений, своих собственых или чужих, путем анализа которых выяснится, что изменение условий не позволяет достигнуть нужного состояния.
>Большинство школьников мне отвечают что электроны вращаются вокруг ядра
Это вопрос, который до сих пор неясен.

Стой стой, что значит неясен? Всё ясно уже лет 60, там уравнения дают такую точность, будто ты измерил радиус земли с помощью ширины волоса. Просто не надо распространять классический взгляд на мир туда, ты же не распространяешь взгляд, что земля плоская, хотя видишь её такой. Для школьников вполне будет достаточно загнать что-нибудь про электронную плотность, и показать на картиночках как она себя между атомами ведет, где "та самая" пара. Что ничего там такого нет, и просто немного стало побольше плотности, примерно как на картинке.
Так есть химики-технологи, они как раз и решают именно задачи получения. Один человек мне как-то сказал: академический химик придумает хитровыебанную и дорогую реакцию с близким к нулю выхлопом и будет несказанно рад, а технолог придумает простую и рабочую реакцию + методику получения.
У них просто разные задачи. Ты бы ещё физика ругал за то, что он не может корректно работу инженера-энергетика выполнять.
61.3 кг хуй пойми чего - это не значит "все ясно", это значит, что какие-то свойства удалось точно оценить. Ты сейчас снова демонстрируешь яркую приверженость заимствованым знаниям, мол "в книжке написали, значит другого и нету", просто у тебя книжка поновее будет, а у них старее, но ты такой же мудак, как те школьники, у которых электрон вращается вокруг ядра.
Про точность волоса и радиуса земли - очень прохладная история, я аж замерз. Какого-то хуя моченым постояно приходится вводить поправочные коэфициенты то там, то тут при расчете аб инитио, потому что они нихуя не сходятся с реальностью.
Я о том и пишу. Академиков можно просто всех уволить, и никто не заметит их отсутствия. По крайней мере так дело обстоит в рашке, где от академиков не требуется разрабатывать работающие методы для заводов. У нас вон недавно был суд, где судили институт, который разработал стандарт для спирта, а стандарт на практике оказался сраным говном не выдерживающим критики.
Они тоже нужны. Технологи же не будут заниматься вопросами квантовой химии и т.д. Просто уже давно нужно разграничить, где наука, а где технология.
Так как это только на словах ab intio, на деле чем-то приближенным считают, на обычном компе, желательно за сутки, а то статью клепать.
Нормальные методы, дают нормальные точности, а решение в лоб, даст безумную точность. По твоим словам и с обычной механикой нихуя не ясно ничего, ведь задача трех тел не решается аналитически. Если у тебя не хватает воображения работать с Гильбертовым пространством, то это твои проблемы, и "неясно что там" только тебе. Ох уж эти неуместные "наука не знает всего",совсем не в тех местах где нужно. Она в курсе что не знает, это её основной вопрос. Ты может еще и гомеопатией увлекаешься? Те тоже так говорят всегда.
почему только один учебник, один это гиблое дело. Надо штуки три четыре. И все читаешь и сравниваешь.
Ну хочу начать с него. Решил узнать отсал ли он от реальности. Шанс не велик, но есть.
Почти всё отсасывает от реальности, увы) Но с разной глубиной. Тебе принципиально бумажный учебник?
нет, мне нужны структурированные данные для дауна. Что было понятно. Базовые знания 11 класов есть. Плюс еще чутка физику хорошо понимаю. Сейчас собираюсь на медицинский и решил основательно подойти к химии. (Изучить как можно больше, даже то что не надо) Но, увы, нет навыка поиска учебников. Да и вообще специальной информации по определенным предметам.
>>410644
>на пикрелейтед предыдущего поста - это, походу, термоядерная реакция слияния ядер дейтерия с атомной массой 2,0152 каждый
Не, это скорее сумма масс двух протонов и двух нейронов в ядре атома гелия соответственно. Пик1.
И дефект масс, обусловленный наличием
энергии связи у этих четырёх нуклонов. Пик2.
А вот удельная энергия связи на нуклон - у пик3.
Я одного не пойму, действительно ли, чтобы оторвать нуклон из альфа-частицы нужно приложить 7 мегаэлектронвольт, либо же 14, так как какждый нуклон связан с двумя остальными. Пик4.
ЕМНИП, немного, хотя мой семинарист по неорганике его очень хвалил.
>>412703
>и насколько много они знали про вещества и их превращения
Это такая шутка? Тогда только-только начали развиваться представления о строении веществ. С номенклатурой стали разбираться спустя лет десять.
>>412432
Если с нуля, то учебник Кузьменко, Ерёмина и Попкова. По неорганике - учебники Третьякова и Хьюи, по органике можно начать с учебника Тернея.
>>412380
> Вопрос такой: я школьник, обожаю химию, но терпеть не могу биологию, какие есть области химии, профессии, факультеты в вузах максимально далёкие от биологии?
Почти все.
Расскажи мне охуенную историю о том, как волновая функция решает вот этот вопрос: https://ru.wikipedia.org/wiki/Редукция_фон_Неймана
Вроде волна, а тут хуяк - и не волна, а почему - ты не знаешь, но "не знаю" - это запретное в ваших кругах слово.
Волновая функция - это ограниченая систематизация экспериментальных сведений. Далеко не исчерпывающая систематизация, и далеко не исчерпывающие экспериментальные сведения. К тому же, модель настолько сложна, что один атом углерода будешь считать неделю на суперкомпьютере.
"Гомеопатия (от греч. ὅμοιος — «подобный» и πάθος — «болезнь») — вид альтернативной медицины, предполагающий использование сильно разведённых препаратов,[1] которые предположительно вызывают у здоровых людей симптомы, подобные симптомам болезни пациента." - хуйня какая-то, не знаю, при чем тут она.
>Это такая шутка? Тогда только-только начали развиваться представления о строении веществ. С номенклатурой стали разбираться спустя лет десять.
Знания об устройстве футбольного мяча и их номенклатура не помогают тебе лучше играть в футбол. Знания практической химии теряются угрожающими темпами, не в последнюю очередь из-за увеличения размера самой инфы и возникновения популярного информационого пространства, создаваемого малоквалифицироваными людьми (95% людей - идиоты). Благо, возникают электронные архивы, которые повышают доступность информации.
Все модели атомов до сих пор являются бесполезными для предсказания результатов реакции, потому практика является решающей.
PS: и я еще хотел бы узнать, откуда у тебя инфа про безумные точности. Есть ли хотя бы одно исследование со схождение в 3 знака?
>Технологи же не будут заниматься вопросами квантовой химии и т.д. Просто уже давно нужно разграничить, где наука, а где технология.
Представь себе, на западе химики, которые делают квантовые расчеты, применяют их для оптимизации хим процесов. Только в рашке и зимбабве химики занимаются квантовой химией для распила бюджета.
Очень легко. Никакой редукции нет, она лишь наше субъективное наблюдение. Если ты простенький эксперимент поставишь, и попробуешь описать его уравнением шредингера, не забыв вписать туда еще и свою волновую функцию, то получишь что ты сам должен быть в суперпозиции после эксперимента, и на каждый вариант данных, будет одно твоё чистое квантовое состояние, которое видит редукцию, так как собственные волновые функции ортогональны, то никакого взаимодейтствия между тобой в разных состояниях быть не может. Чтобы это доказать надо проверить суперпозицию на макрообъекте, что крайне сложно, придется его полностью изолировать, а то он заразит тебя своей суперпозицией. Недавние исследования показали что для миллиардов атомов вполне работает, и скорее всего ограничения нет. Так же на подобные мысли наводят эксперименты с "ластиком". Где данные считывают,и сразу удаляют, редукции при этом никакой не наступает, ведь удалением мы не дали взаимодействовать прибору с собой. При таком подходе локальность не нарушается, и сохраняется детерминизм.
Расчет энергии ионизации легких атомов например точен что пиздец. Для тежелых посложнее, но если подпрячься, то норм.
вот как пример https://journals.aps.org/prl/abstract/10.1103/PhysRevLett.118.023002
После адового траха смогли подогнать точность расчета двух параметров для одного элемента с двух до трех знаков при известном правильном ответе. Более высокая точность достигнута разве что для атома водорода, по которому, как бы, все коэфициенты и подгоняются.
>>412780
Никто не знет, что такое электрон. Никто не знает, что такое гравитация. Никто не знает, каким образом поля и материя - едины. Электрон представляет собой простейший вариант демонстрации удивительной природы материи, когда частица становится размазанной в пространстве, каким-то образом не взаимодействует с одной материей, взаимодействуя в то же время с точно такой же материей, находящейся в другом состоянии. Каким образом состояние передается?
Электрон и позитрон при соединении образуют несколько гамма квантов - как мне сделать электрон из гамма кванта? Ты не знаешь, пидар гнойный, но не можешь в этом признаться. Как шаман, который научился предсказывать погоду по тучам, и пытается этим произвести впечатление на соплемеников, однако же он не понимает, что такое туча и почему она возникает.
Я спокойно признаюсь что не знаю. Я не знаю этого, и никто пока не знает. Но при чем тут строение атома? Атом был загадкой сто лет назад, а сейчас уже нет. Ты перевел на строение материи и электрона. Подобным образом можно доказать, что любой человек ничего не знает. Буду спрашивать бесконечно "а почему?" ты дойдешь до границы известных законов. И я сделаю вывод, что ничего ты не знаешь, даже почему огонь горит. Ты занимаешься банальной софистикой, ебаный демагог.
Давай вернемся вот сюда:
>>Большинство школьников мне отвечают что электроны вращаются вокруг ядра
>Это вопрос, который до сих пор неясен.
https://ru.wikipedia.org/wiki/Ларморовская_прецессия - электрон ведет себя как заряженая частица, которая вращается по кольцевой орбите, создавая магнитный момент, и точно так же, как вращающаяся частица, может прецесировать. Что такое электрон - мы не знаем, мы знаем лишь свойства. Исходя из этого свойства можно говорить о том, что "электрон вращается вокруг ядра" - это коректное утверждение, но анон выше мне пытался доказать, что ему известно какое-то истиное знание об электронах, которое позволяет ему говорить, что ничего не вращается.
>Знания практической химии теряются угрожающими темпами, не в последнюю очередь из-за увеличения размера самой инфы и возникновения популярного информационого пространства, создаваемого малоквалифицироваными людьми (95% людей - идиоты).
Которые, как ни странно, надо систематизировать. Вот тут-то и понадобятся и номенклатура, и представления о строении. И ты не забывай, что той же органики без хотя бы простого понимания строения вещества не будет.

Глинка лучший учебник по химии!
Я в курсе что у у атома есть момент. Но например у S орбитали момента нет(кроме собсвенного момента электрона, который не связан с орбитальным движением).Ларморовская прецессия это блять квазиклассическое описание. "КВАЗИКЛАССИЧЕСКОЕ", вращения в нашем понимании там нет, это лишь способ перейти на что-то более нам наглядное.
Ты даже сам не понимаешь кого пытаешься поймать на ларморовской прецессии, я занимаюсь на работе конкретно ей. Кстати тоже бомблю, когда пишут в учебниках, что спин прецессирует, забывая показать что это просто квазиклассическая модель, и нихуя там не прецессирует.
Ну и как это противоречит-то? Или хочешь сказать, что на швятом один и тот же химик и квантовые расчёты делает, и для завода тех. процесс пишет? Даже в РФ обычно не так, но ведь у нас страна чудес, так что по-всякому бывает.
Чего тебе не понятно, школьник?
Считаешь общее число электронов в задании, смотришь в таблицу, ищешь номер равный количеству насчитанных электронов, если есть такой ответ - изи, если нет то смотришь ближайшие атомы
У атомов с зарядами - электронов больше, у атомов с зарядами + электронов меньше такая логика в химии, запомни ее раз и навсегда ищешь атом из ответов который подходит под число электронов данных в задании
Done
ЧТОО!? АХАХАХАХ
Где ты видел что бы химик ТЕХНОЛОГ кванты считал? Нахуя это ему? Это на уровне, если у тебя говно из унитаза потечет, придет сантехник и что бы починить унитаз будет пол дня расчитывать длинны волн де Бройля, мол из за них унитаз сломался.
В масштабах в которых работают практики - одни законы, теоретики - другие. Это нормально, покрайне мере пока мы не познали весь материальный мир до конца, но до этого еще долгий путь ты сука
Да элементарный гетерогенный катализ. Можно очень и очень долго тыкаться с тупым подбором катализаторов (что в свое время делали, например, для получения аммиака), а можно попытаться смоделировать поверхность и выбрать наиболее подходящую из уже известных поверхностей.
В фармацевтике моделирование применяется для ускорения подбора подходящих к рецептору веществ.
Я не понимаю в чем смысл твоего адвокатирования бесполезных теоретиков. Типа что ты сам теоретик и пытаешься показать нам важность своей работы? Впрочем, я не вижу чтобы ты пытался это сделать.
Да он скорее наоборот пытается обосрать. Лел. Вы бля такую хуйню несете тут, будто никогда не видели нормальную работу в науке.
Теоретик никогда ничего из пустоты считать не будет. Почти всегда есть конкретная задача.
Теория магнетизации орбиталей - это довольно новая хуйня, разработанная только в этом тысячелетии https://en.wikipedia.org/wiki/Orbital_magnetization .
Я никак не могу объяснить существование орбиталей с нулевым магнитным квантовым числом, ну то есть что такое и почему оно возникает.
Спин действительно участвует в магнетизме и эфекте зеемана, но не является основным действующим лицом, а основным является все-таки что-то, что именуется магнитным квантовым числом.
>>412849
Ты давай мне не путай. В мурике от ученых периодически требуют подтвердить ученого на практических задачах, что он не конченый мудак. В рашке этого требования в гос учреждениях обычно не предъявляется.
Просто надо забыть что существует классическая механика, и воспринимать её как следствие квантовой. И не пытаться представлять себе электрон как конкретную частицу, если всё же соблазн есть, то тогда надо это делать в определении квантовой механики через интегралы по траекториям. Уравнение шредингера это уравнение диффузии с мнимым коэффом диффузии, поэтому нет ничего удивительного что плотность просто прилепилась к заряду, и висит на нём как газовое облако в космосе вокруг объекта с массой.
Может ли гидрид магния, подобно гидриду лития реагировать с хлоридом индия,
образуя гидрид индия и хлорид магния?
Если да, то каковы условия реакции и нужен ли диэтиловый эфир?
Идешь в справочник и смотришь термодинамические данные. Считаешь. В таких реакциях кинетика редко мешает.

Ну эта блять, надо смотреть потенциальную энергию реакции. Вероятнее всего она пойдет но её придется для этого нагреть.

Можно было бы и попробовать, нас легион же, лол.
Галлий вроде-бы можно получить из термопасты ЖМ-6 или других термопаст из жидких металлов.
Просто в соляную кислоту жидкий металл, и там хлорид галлия.
Но надо ещё надобно магний, йод, и водород.
Гидрид магния - получают реакцией магния с водородом при 570С и 200 атмосфер
в присутствии иодида магния. (выход 60%).
Алсо, вот ещё вопрос что значит слово краен.:
OsO4 + 2(NH3⋅H2O)[конц] = (NH4)[OsO4(OH)2](краен.) [комн.]
Я так понимаю, комн. - значит комнатная температура.
Это — перросмат аммония.
Возможно из него получилось бы получить высший гидридный комплекс,
наподобие реакции с перренатом аммония:
NH4ReO4+18Na+13C2H5OH -> Na2[ReH9]↓+13C2H5ONa+3NaOH + NH3⋅H2O
Если аммиак предварительно осушить концентрированной серной кислотой,
либо же отнять воду серным ангидридом к примеру превратив (NH4)[OsO4(OH)2]
во что-то вроде (NH4)[OsO4].
Этот комплексный гидрид мог бы иметь вид Na2[OsH11], но если натрий заменить на магний,
то что-то вроде Mg[OsH11], тогда такой гидрид содержал бы по 11 атомов водорода -
на два атома каждого из связующих элементов, т. е. около 5,5 атомов водорода на каждый атом.
Это было бы одно из наилучших хранилищ для водорода,
особенно если это вещество - было бы кристаллическим и разлагалось водой.
Как к примеру, разлагается нонагидридоренат(VII)натрия - водой:
Na2[ReH9]+5H2O —100C—> NaReO4 + NaOH + 9H2↑
Подобная реакция для декагидридоосмата(VIII)магния давала бы на выходе
аж 10 молекул водорода в водородном топливном баке какого-нибудь электромобиля:
Mg[OsH11]+6H2O —> MgOsO4 + Mg(OH)2 + 10H2↑

Можно было бы и попробовать, нас легион же, лол.
Галлий вроде-бы можно получить из термопасты ЖМ-6 или других термопаст из жидких металлов.
Просто в соляную кислоту жидкий металл, и там хлорид галлия.
Но надо ещё надобно магний, йод, и водород.
Гидрид магния - получают реакцией магния с водородом при 570С и 200 атмосфер
в присутствии иодида магния. (выход 60%).
Алсо, вот ещё вопрос что значит слово краен.:
OsO4 + 2(NH3⋅H2O)[конц] = (NH4)[OsO4(OH)2](краен.) [комн.]
Я так понимаю, комн. - значит комнатная температура.
Это — перросмат аммония.
Возможно из него получилось бы получить высший гидридный комплекс,
наподобие реакции с перренатом аммония:
NH4ReO4+18Na+13C2H5OH -> Na2[ReH9]↓+13C2H5ONa+3NaOH + NH3⋅H2O
Если аммиак предварительно осушить концентрированной серной кислотой,
либо же отнять воду серным ангидридом к примеру превратив (NH4)[OsO4(OH)2]
во что-то вроде (NH4)[OsO4].
Этот комплексный гидрид мог бы иметь вид Na2[OsH11], но если натрий заменить на магний,
то что-то вроде Mg[OsH11], тогда такой гидрид содержал бы по 11 атомов водорода -
на два атома каждого из связующих элементов, т. е. около 5,5 атомов водорода на каждый атом.
Это было бы одно из наилучших хранилищ для водорода,
особенно если это вещество - было бы кристаллическим и разлагалось водой.
Как к примеру, разлагается нонагидридоренат(VII)натрия - водой:
Na2[ReH9]+5H2O —100C—> NaReO4 + NaOH + 9H2↑
Подобная реакция для декагидридоосмата(VIII)магния давала бы на выходе
аж 10 молекул водорода в водородном топливном баке какого-нибудь электромобиля:
Mg[OsH11]+6H2O —> MgOsO4 + Mg(OH)2 + 10H2↑
>Mg[OsH11]
Mg[OsH10] вот так бы примерно это выглядело, точнее MgH[OsH9],
потому что гидрид магния MgH2 а у осмия валентность 8, поэтому 8 связей с водородом в гидрид-ионе,
+1, максимум 2, если гидрид-ион OsH10 - имеет заряд 2+.
Таким образом 11 протонов не должно быть там, поэтому по 5 атомов на каждый связывающий элемент.
>Ты школьник чтоли?
С чего взял?
>Такие наивные рассуждения.
Ну я их аргументировал.
>Будто только на бумаге видел.
Не, загуглил. Вообще-то смотрел в высшую валентность элементов в образуемых ими гидрид-ионах,
что-то типа алюмогидридов и боргидридов.
Вижу вот у осмия она (VIII), есть ещё рутений - он полегче, ну и чуток погуглил комплексные гидриды рутения. И ничего не понял там.
Задача состоит напхнуть побольше водорода и забить протонами элемент по всей его валентности,
образовав высший гидрид, но не выпустить его в виде газа, потому что например...
Плюмбан, метан, станнан, силан, герман, галлан - это газы, да ещё и ядовитые.
А в комплесных ионах они связываются в кристаллические комплексные гидриды, легко разлагающиеся как правило водой.
Поэтому и захотелось найти или синтезировать комплексный гидрид, который содержал
бы наибольшее число атомов водорода в своём составе,
и давал бы наибольшее количество молекул водорода при разложении его водой.
Опыты не проводил конечно же. Вот так как-то...
Ну банально хотя бы прикинь энергию Гиббса у этой реакции. Может реакция вообще невозможная.
Клево конечно. Но ценится водород на грамм вещества. А ты осмий хочешь, лол. Бериллия гидрид заебись, например, или LiBeH4 тоже заебись.
>LiBeH4
Нет такого, есть LiBeH3 and Li2BeH4
Алсо, я по объему смотрю, потому что иначе не паковали бы водород в кристаллы гидридов,
а возили бы в водородных баках чистый водород с его 100%-м содержанием по массе.
Причём даже в виде газа и не взирая на объем.
Где их найти эти энергии Гиббса, как их рассчитать блин?
Знаю, только что индий восстанавливается магнием из оксидов, да,
и что соль хлорида магния крепче гидрида магния и даже гидрида индия должна быть.
Но что с энергиями - не пойму...
Вот например, хлорид индия из оксида: In2O3 + 6HCl = 2InCl3 + 3H2O, ΔG0298 = -25 кДж/моль.
И восстановление индия из оксида магнием: Оксид индия (III) In2O3.
Растворимый в кислотах аморфный порошок или желтые (красно-коричневые при нагревании)
тригональные кристаллы ( tпл=1910°С, tпл=850°С [2], плотность равна 7,18 г/см3 [2]),
мало растворимые в воде, кислотах и щелочах.
Восстанавливается до металлического индия водородом, натрием, магнием или углем.
Получают нагреванием металлического индия выше температуры плавления на воздухе или в кислороде,
или прокаливанием гидроксида, нитрата, сульфата или карбоната индия (III).
ΔH298(обр) = -925,92 кДж/моль; ΔG298 = -831,98 кДж/моль; S298 = 107,95 Дж/моль.K
Ну и вот есть реакция получения алюмогидрида лития:
AlCl3 + 2LiH -> Li[AlH4] + 3LiCl;
С дальнейшим образованием гидрида алюминия из комплексного гирида:
AlCl3 + 3Li[AlH4] -> 4AlH3 + 3LiCl;
А также реакция получения гидрида алюминия из гидрида магния:
2AlCl3+3MgH2 -> 2AlH3+3MgCl2;
Вот таким вот образом, который описан в этом патенте: http://www.freepatentsonline.com/5670129.pdf
Так вот, я просто смотрел на то, что соли хлорида лития и хлорида магния - имеют более сильную ионную связь,
а также литий и магний - более активны нежели алюминий, поэтому алюминий связывается в гидрид,
и полагаю что если алюминий заменить индием реакция пройдёт примерно так же,
даже в присутствии гидрида магния, но возможно с промежуточным образованием
комплексного гидрида, c содержанием гидрид-иона магния. А в энергиях этих и энтальпиях - нифига не шарю.
Гидрид индия как и гидрид алюминия содержит 3 атома водорода на один атом связующего,
к тому же индий, получают его из гидрида лития, а разлагается уже при 80 градусах с выделением водорода.
Индий более инертный и лучше плавится нежели алюминий, и растворив его в соляной кислоте, можно было бы
в процессе получения исходного хлорида индия - ещё и дополнительный водород наработать.
Где их найти эти энергии Гиббса, как их рассчитать блин?
Знаю, только что индий восстанавливается магнием из оксидов, да,
и что соль хлорида магния крепче гидрида магния и даже гидрида индия должна быть.
Но что с энергиями - не пойму...
Вот например, хлорид индия из оксида: In2O3 + 6HCl = 2InCl3 + 3H2O, ΔG0298 = -25 кДж/моль.
И восстановление индия из оксида магнием: Оксид индия (III) In2O3.
Растворимый в кислотах аморфный порошок или желтые (красно-коричневые при нагревании)
тригональные кристаллы ( tпл=1910°С, tпл=850°С [2], плотность равна 7,18 г/см3 [2]),
мало растворимые в воде, кислотах и щелочах.
Восстанавливается до металлического индия водородом, натрием, магнием или углем.
Получают нагреванием металлического индия выше температуры плавления на воздухе или в кислороде,
или прокаливанием гидроксида, нитрата, сульфата или карбоната индия (III).
ΔH298(обр) = -925,92 кДж/моль; ΔG298 = -831,98 кДж/моль; S298 = 107,95 Дж/моль.K
Ну и вот есть реакция получения алюмогидрида лития:
AlCl3 + 2LiH -> Li[AlH4] + 3LiCl;
С дальнейшим образованием гидрида алюминия из комплексного гирида:
AlCl3 + 3Li[AlH4] -> 4AlH3 + 3LiCl;
А также реакция получения гидрида алюминия из гидрида магния:
2AlCl3+3MgH2 -> 2AlH3+3MgCl2;
Вот таким вот образом, который описан в этом патенте: http://www.freepatentsonline.com/5670129.pdf
Так вот, я просто смотрел на то, что соли хлорида лития и хлорида магния - имеют более сильную ионную связь,
а также литий и магний - более активны нежели алюминий, поэтому алюминий связывается в гидрид,
и полагаю что если алюминий заменить индием реакция пройдёт примерно так же,
даже в присутствии гидрида магния, но возможно с промежуточным образованием
комплексного гидрида, c содержанием гидрид-иона магния. А в энергиях этих и энтальпиях - нифига не шарю.
Гидрид индия как и гидрид алюминия содержит 3 атома водорода на один атом связующего,
к тому же индий, получают его из гидрида лития, а разлагается уже при 80 градусах с выделением водорода.
Индий более инертный и лучше плавится нежели алюминий, и растворив его в соляной кислоте, можно было бы
в процессе получения исходного хлорида индия - ещё и дополнительный водород наработать.

Кстати чуть не забыл, ты уверен что аммиачком то можно на осмий восемь? Там осмиамат, так то может получиться, и скорее всего получится.
>ты уверен что аммиачком то можно на осмий восемь
Не уверен, но оксид осмия - кислотообразующий оксид,
и образует осмиевую кислоту: H2OsO4.
Этим он подобен SO3 с его H2SO4, а реакция SO3 с аммиаком идёт так:
NH3 + SO3 + H2O = (NH4)2(SO4)
Алсо, и с оксидом рения (VII) - оно так-то и идёт:
Re2O7 + 2(NH3 H2O) [конц., гор.] = 2NH4ReO4 + H2O.
Вот что нагуглил: OsO4 + 2(NH3•H2O) → (NH4)2[OsO4(OH)2]
Но (NH4)2[OsO4(OH)2] не (NH4)2[OsO4], т. е. не перросмат аммония,
это какой-то гидроксиперросмат что-ли, поэтому можно было бы его ещё
мокнуть в серную кислоту, чтоб вот эти мозолящие глаза, гидроксильные группы
убрать и как воду отнять оттуда и всё. Тогда, может и получиться перросмат аммония, потом.
Алсо, можно ещё и оксид рутения (VIII) попробовать и оксид марганца (VIII).
Ну и оставлю здесь ещё вот такой комплексный гидрид: MgFeH6.
У него 3 атома водорода на каждый атом связующего элемента, как и у AlH3.
>Там осмиамат, так то может получиться, и скорее всего получится.
Хим формула: NH4•OsO3N
https://www.ifcg.ru/info/tnved/notes/code/2843
Соединения осмия. Диоксид осмия (OsO2) - темно-коричневый порошок.
Тетраоксид осмия (OsO4) - летучий твердый продукт,
кристаллизующийся в виде белых игольчатых кристаллов;
он действует на глаза и легкие; используется в гистологии и микрографии.
Тетраоксид дает осматы, такие как осмат калия (красные кристаллы),
а при обработке аммиаком и гидроксидами щелочных металлов - осмиаматы (с азотом внутри иона: NH4•OsO3N),
такие как осмиамат калия или натрия, представляющие собой желтые кристаллы.
Тетрахлорид осмия (OsCl4) и трихлорид осмия (OsCl3) дают хлороосматы и хлороосмиты щелочных металлов.
Короче, Тетраоксид дает осматы. OsO4 -> K2OsO4, Na2OsO4;
А нонагидридоренат получают при восстановлении перрената аммония натрием в этаноле.
Можно было бы попробовать в этаноле металлическим натрием — восстановить осмат калия,
или наоборот, осмат натрия - восстановить металлическим калием и получить гидрид.
Там калий, походу восстанавливает натрий или наоборот - я уже и не помню и не гуглится это...
Хм... Во!.. Калий активние натрия же, значит осмат натрия металлическим калием в спирте.
А алкоголяты калия потом водой залить, спирт восстановить, и калиевую щелочь слить,
под электролиз расплава для получения исходного калия.
Ты не понял, но твои реакции неправильные. Не знаю где ты их блин берешь. И бля, ты толи реально только на уровне школы химию знаешь. Или тонкий тролль, хуйню пишешь и сам не понимаешь. Лел.
>Ты не понял, но твои реакции неправильные.
Что конкретно неправильно?
>Не знаю где ты их блин берешь.
Спроси про конкретную реакцию, дам источник.
>И бля, ты толи реально только на уровне школы химию знаешь.
>Или тонкий тролль, хуйню пишешь и сам не понимаешь. Лел.
Ну, вот смотри, ещё раз.
Есть реакция получения гидрида Na2[ReH9]:
NH4ReO4+18Na+13C2H5OH -> Na2[ReH9]↓+13C2H5ONa+3NaOH + NH3⋅H2O
Это - с википедии: https://ru.wikipedia.org/wiki/Нонагидридоренат(VII)_натрия
Для неё надо NH4ReO4.
Я предложил, вместо него использовать NH4OsO4, и получить нечто вроде
Na2[OsH10], где ещё больше протонов.
Но NH4OsO4 ещё синтезировать надо, и с нашатырным спиртом NH4•H2O тетраоксид осмия даёт осмиаматы (с азотом внутри иона: NH4•OsO3N);
Поэтому можно попытаться восстановить гидрид металлическим калием,
из осмата натрия: Na2OsO4, в среде этилового спирта, как на первой реакции.
Почему осмий? У него валентность (VIII), и высший гидрид осмия,
если его конечно ещё получится сделать, должен будет дохрена водорода в себя вмещать,
и выделять этот водород при разложении его водой, также как его выделяет этот
Нонагидридоренат (VII) натрия. Но натрия - два атома, а если был бы магний,
тогда в соединении два атома лишь, магний и осмий, а остальное - 10 атомов водорода в гидриде.
А натрий магнием из соединения не восстановишь, поэтому короче,
10 / 3 атома (2 натрия или калий + осмий) = 3,33 - чуток больше атомов водорода приходится,
чем у AlH3, но это такой мудатории не стоит.
А вот у Mg[OsH10], если получилось сделать такой гидрид, по 5 атомов водорода было бы,
потому что 10 / 2 (атом магния + атом осмия) = 5;
А это уже намного больше, чем у всяких там каких-то диборанов, метанов,
и прочих гидридов из которых при разложении выделяется водород,
у них не больше 3 атома на связующий элемент. А если больше - то это ядовитые газы в основном.
>Ты не понял, но твои реакции неправильные.
Что конкретно неправильно?
>Не знаю где ты их блин берешь.
Спроси про конкретную реакцию, дам источник.
>И бля, ты толи реально только на уровне школы химию знаешь.
>Или тонкий тролль, хуйню пишешь и сам не понимаешь. Лел.
Ну, вот смотри, ещё раз.
Есть реакция получения гидрида Na2[ReH9]:
NH4ReO4+18Na+13C2H5OH -> Na2[ReH9]↓+13C2H5ONa+3NaOH + NH3⋅H2O
Это - с википедии: https://ru.wikipedia.org/wiki/Нонагидридоренат(VII)_натрия
Для неё надо NH4ReO4.
Я предложил, вместо него использовать NH4OsO4, и получить нечто вроде
Na2[OsH10], где ещё больше протонов.
Но NH4OsO4 ещё синтезировать надо, и с нашатырным спиртом NH4•H2O тетраоксид осмия даёт осмиаматы (с азотом внутри иона: NH4•OsO3N);
Поэтому можно попытаться восстановить гидрид металлическим калием,
из осмата натрия: Na2OsO4, в среде этилового спирта, как на первой реакции.
Почему осмий? У него валентность (VIII), и высший гидрид осмия,
если его конечно ещё получится сделать, должен будет дохрена водорода в себя вмещать,
и выделять этот водород при разложении его водой, также как его выделяет этот
Нонагидридоренат (VII) натрия. Но натрия - два атома, а если был бы магний,
тогда в соединении два атома лишь, магний и осмий, а остальное - 10 атомов водорода в гидриде.
А натрий магнием из соединения не восстановишь, поэтому короче,
10 / 3 атома (2 натрия или калий + осмий) = 3,33 - чуток больше атомов водорода приходится,
чем у AlH3, но это такой мудатории не стоит.
А вот у Mg[OsH10], если получилось сделать такой гидрид, по 5 атомов водорода было бы,
потому что 10 / 2 (атом магния + атом осмия) = 5;
А это уже намного больше, чем у всяких там каких-то диборанов, метанов,
и прочих гидридов из которых при разложении выделяется водород,
у них не больше 3 атома на связующий элемент. А если больше - то это ядовитые газы в основном.

нет каких-нибудь годных видеолекций на англе по органической химии? чтобы общий курс и с нормальным графическим контентом?
в частности ужасно заебало по тексту разбираться в механизме центров активности, я нихуя не понимаю
>ценится водород на грамм вещества
>LiBeH3 and Li2BeH4
Ну, если так, то тогда лучше уже чистый гидрид бериллия: BeH2,
поскольку это кристаллическое вещество, лёгкое, и на каждый атом бериллия
приходится по 2 атома водорода, как и у гидрида магния.
У LiBeH3 меньше: 3/2 (Li + Be) = 1,5 атома водорода.
У Li2BeH4 ещё меньше: 4/3 (2Li + Be) = 1⅓ атома водорода.
Но проблема в том, что в отличие от гидрида магния, его не так просто получают.
BeH2 разложением диметилбериллия, с образованием этана С2H6.
А для диметилбериллия - есть реакция хлорида бериллия с реактивом Гриньяра CH3MgI,
в атмосфере водорода или азота. Этот реактив синтезируют так: CH3I + Mg = CH3MgI
а CH3I, чтоб получить, из побочного этана С2H6 - надо, провести термическое дегидрирование
этого этана при 550—650 °С, которое приводит к этилену, с последующей гидратацией этилена.
CH2=CH2 + H2O → C2H5OH, а потом сжечь этанол:
C2H5OH + 3O2 -->(t) 2CO2 + 3H2O
и насытить водородом образовавшийся углекислый газ с получением метанола:
CO2 + 3H2 <--> CH3OH + H2O + 49.53 кДж/моль
После чего сыпнуть к нему ещё и трийодида фосфора:
3CH3OH + PI3 → 3CH3I + H3PO3
Или смешать метанол с серной кислотой, и диметилсульфату щедро напихать йодида калия:
(CH3)2SO4 + KI → K2SO4 + 2 CH3I
Для очистки CH3I может быть обработан Na2S2O3 для удаления иода.
Очистку также можно осуществить обработкой раствором соды с последующей
сушкой над плавленным хлористым кальцием и перегонкой.
И только потом, походу, можно будет этот йодметан с магнием смешать, чтоб вернуть
потраченный на синтез гидрида бериллия реактив Гриньяра.
Это целая установка органического синтеза, и в бак электромобиля её не запхнёшь,
можно только на заправку вынести, чтобы все охуели.
Поэтому проще с теми же двумя атомами водорода на один атом связующего
гидрировать магний вместо бериллия - и обратимо юзать с водородом гидрид магния.
Получают гидрид магния - реакцией магния с водородом при 570°С и 200 атмосфер
в присутствии иодида магния. (выход 60%), либо же — в результате взаимодействия LiH с магнийалкилами.
>ценится водород на грамм вещества
>LiBeH3 and Li2BeH4
Ну, если так, то тогда лучше уже чистый гидрид бериллия: BeH2,
поскольку это кристаллическое вещество, лёгкое, и на каждый атом бериллия
приходится по 2 атома водорода, как и у гидрида магния.
У LiBeH3 меньше: 3/2 (Li + Be) = 1,5 атома водорода.
У Li2BeH4 ещё меньше: 4/3 (2Li + Be) = 1⅓ атома водорода.
Но проблема в том, что в отличие от гидрида магния, его не так просто получают.
BeH2 разложением диметилбериллия, с образованием этана С2H6.
А для диметилбериллия - есть реакция хлорида бериллия с реактивом Гриньяра CH3MgI,
в атмосфере водорода или азота. Этот реактив синтезируют так: CH3I + Mg = CH3MgI
а CH3I, чтоб получить, из побочного этана С2H6 - надо, провести термическое дегидрирование
этого этана при 550—650 °С, которое приводит к этилену, с последующей гидратацией этилена.
CH2=CH2 + H2O → C2H5OH, а потом сжечь этанол:
C2H5OH + 3O2 -->(t) 2CO2 + 3H2O
и насытить водородом образовавшийся углекислый газ с получением метанола:
CO2 + 3H2 <--> CH3OH + H2O + 49.53 кДж/моль
После чего сыпнуть к нему ещё и трийодида фосфора:
3CH3OH + PI3 → 3CH3I + H3PO3
Или смешать метанол с серной кислотой, и диметилсульфату щедро напихать йодида калия:
(CH3)2SO4 + KI → K2SO4 + 2 CH3I
Для очистки CH3I может быть обработан Na2S2O3 для удаления иода.
Очистку также можно осуществить обработкой раствором соды с последующей
сушкой над плавленным хлористым кальцием и перегонкой.
И только потом, походу, можно будет этот йодметан с магнием смешать, чтоб вернуть
потраченный на синтез гидрида бериллия реактив Гриньяра.
Это целая установка органического синтеза, и в бак электромобиля её не запхнёшь,
можно только на заправку вынести, чтобы все охуели.
Поэтому проще с теми же двумя атомами водорода на один атом связующего
гидрировать магний вместо бериллия - и обратимо юзать с водородом гидрид магния.
Получают гидрид магния - реакцией магния с водородом при 570°С и 200 атмосфер
в присутствии иодида магния. (выход 60%), либо же — в результате взаимодействия LiH с магнийалкилами.
Блядь, я как глянул на цену этого осмия - чуток прихуел. Он по граммам продаётся...
200 000 $ за 1 грамм 187-го осмия, и 19$ за 1 грамм обычного осмия.
http://qbici.ru/nauka/samye-dorogie-metally-v-mire-1-mesto-kalifornij/
Так что c такими гидридными изъебствами - проще в палладии водород хранить.
Цена палладия 24,50 доллара за грамм.
Один объём палладия поглощает до 850 объёмов молекулярного водорода,
взятого при нормальных условиях.
Чему равна масса водорода, которую поглощает 1 г палладия?
В каком состоянии находится в палладии поглощённый водород – в молекулярном,
атомарном, растворённом или химически связанном?
Почему палладий, и содержащийся в нём растворённый водород, разогреваются на воздухе?
До каких температур может разогреться водород, адсорбированный в палладии - на воздухе?
Пытаясь ответить на некоторые из этих вопросов вот что у меня получилось:
Плотность водорода: 0,0000899 г/см³ 850 см³ = 0,076415 г.
Плотность палладия: 12,02 г/см³
1 см3 палладия имеет массу 12,02 г.
В 1 см3 растворяется 850 см3 водорода.
Масса 850 см3 водорода при плотности 0,0000899 г/см³ составляет: 850 см3 0,0000899 г/см³ = 0,076415 г.
0,076415 г. растворяется в 12,02 г. палладия.
По массе соотношение 0,076415 г. / 12,02 г. = 0,0063573211314475873544093178036606 * 100% = 0,635% по массе.
По молям:
1 см3 палладия имеет массу 12,02 г. Молярная масса палладия 106,42 г/моль.
В 1 см3 палладия содержится 0,11294869 моль.
0,076415 г. при молекулярной массе водорода в 2 г/моль даёт 0,0382075 моль молекулярного водорода.
Соотношение vH/vPd = 0,34 по молям. Т. е. 34% молей водорода в 1 моле палладия.
И т. к. около трети водорода на 1 моль палладия, значит формула гидрида у палладия примерно Pd3H
Вот что нашёл:
Фрицман, рассматривая каталитическую активность водородистого палладия,
указывает, что в соединениях с палладием водород имеет необычную валентность(Pd2H, Pd3H)
вследствие перехода в металлическое состояние.
Металлические гидриды (МехНу) подобны металлорганическим соединениям или металалкилам,
в которых алкильные группы соединены с элементом.
http://www.ngpedia.ru/id641549p2.html
Короче, что-то подобное походу происходит, когда накачивают водород в палладий.
Что касается палладия, цена которого 24,50 доллара за грамм -
так его проще получить из урана-238, цена которого 25 USD/kg.
Но для этого нужен источник нейтронов. Таким источником могла бы быть установка,
подобная той, которой вышибали нейтроны техасским петаваттным лазером.
Схема такая: n + 238U -> 239Np -> Pu239 + n -> реакция деления + энергия.
При делении плутония-239 идёт ядерная реакция с выделением тепла:
239Pu + n -> 105Ru + 132Sn + 3n (т. е. деление ядра и разлёт осколков)
Пруф - внутри видео >>411542. Лол. Лушче источника реакции с осколками - не нашёл.
Не гуглятся чё-то осколки деления плутония-239.
Разумеется, реакцию следует проводить управляемо, с замедлением осколков,
отводом их от облучения нейтронами и поглощением их энергии.
Целевой продукт - рутений-105 распадается в родий, а затем в стабильный палладий.
105Ru(4.44(2)h, β−)105Rh(35.36(6)h, β−)105Pd(stable)
Радиоактивное олово при этом распадается так причём одни бета-лучи во всей цепи:
132Sn(39.7(8)s, β−)132Sb(2.79(5)min, β−)132Te(3.204(13)d, β−)132I(2.295(13)h, β−)132Xe(стабильный)
105Pd - составляет 29.3% природного палладия. Является стабильным изотопом и может абсорбировать водород.
Алсо, после 132Sb я вижу йодную яму, а значит внутри реакторов где она есть,
можно надыбать дофига палладия в отработанном топливе, содержащем преимущественно уран-238.
Что касается (VIII)-валентного рутения, стабильный изотоп 104Ru, как указано в примечании здесь:
https://en.wikipedia.org/wiki/Isotopes_of_ruthenium является Fission product,
и действительно, его содержание в отработанных ТВЭЛах достигает 250 граммов
на тонну «сгоревшего» ядерного топлива.
Цена рутения 42 доллара за тройскую унцию (примерно 1,35 $/г).
Также разработана технология получения рутения из технеция-99 с помощью нейтронного облучения молибдена.
Природный молибден состоит из семи стабильных изотопов:
92Мо (15,86% по массе), 94Мо (9,12%), 95Мо (15,70), 96Мо (16,50%), 97Мо (9,45%), 98Мо (23,75) и 100Мо (9,62% по массе).
Молибден, облучается нейтронами для получения молибдена-99, так растёт атомная масса молибдена.
Дальше - цепочка распада:
99Mo(2.7489(6) d, β−)99mTc(6.0058(12)h возврат к стабильному изомеру ядра)99Tc
99Tc(2.111(12)×105 аттосекунд, β−)99Ru(стабильный)
Все предыдущий изотопы молибдена - стабильны, и не распадатся при попадании в них нейтронов.
Таким образом, практически весь молибден — можно выжечь нейтронами в рутений.
Блядь, я как глянул на цену этого осмия - чуток прихуел. Он по граммам продаётся...
200 000 $ за 1 грамм 187-го осмия, и 19$ за 1 грамм обычного осмия.
http://qbici.ru/nauka/samye-dorogie-metally-v-mire-1-mesto-kalifornij/
Так что c такими гидридными изъебствами - проще в палладии водород хранить.
Цена палладия 24,50 доллара за грамм.
Один объём палладия поглощает до 850 объёмов молекулярного водорода,
взятого при нормальных условиях.
Чему равна масса водорода, которую поглощает 1 г палладия?
В каком состоянии находится в палладии поглощённый водород – в молекулярном,
атомарном, растворённом или химически связанном?
Почему палладий, и содержащийся в нём растворённый водород, разогреваются на воздухе?
До каких температур может разогреться водород, адсорбированный в палладии - на воздухе?
Пытаясь ответить на некоторые из этих вопросов вот что у меня получилось:
Плотность водорода: 0,0000899 г/см³ 850 см³ = 0,076415 г.
Плотность палладия: 12,02 г/см³
1 см3 палладия имеет массу 12,02 г.
В 1 см3 растворяется 850 см3 водорода.
Масса 850 см3 водорода при плотности 0,0000899 г/см³ составляет: 850 см3 0,0000899 г/см³ = 0,076415 г.
0,076415 г. растворяется в 12,02 г. палладия.
По массе соотношение 0,076415 г. / 12,02 г. = 0,0063573211314475873544093178036606 * 100% = 0,635% по массе.
По молям:
1 см3 палладия имеет массу 12,02 г. Молярная масса палладия 106,42 г/моль.
В 1 см3 палладия содержится 0,11294869 моль.
0,076415 г. при молекулярной массе водорода в 2 г/моль даёт 0,0382075 моль молекулярного водорода.
Соотношение vH/vPd = 0,34 по молям. Т. е. 34% молей водорода в 1 моле палладия.
И т. к. около трети водорода на 1 моль палладия, значит формула гидрида у палладия примерно Pd3H
Вот что нашёл:
Фрицман, рассматривая каталитическую активность водородистого палладия,
указывает, что в соединениях с палладием водород имеет необычную валентность(Pd2H, Pd3H)
вследствие перехода в металлическое состояние.
Металлические гидриды (МехНу) подобны металлорганическим соединениям или металалкилам,
в которых алкильные группы соединены с элементом.
http://www.ngpedia.ru/id641549p2.html
Короче, что-то подобное походу происходит, когда накачивают водород в палладий.
Что касается палладия, цена которого 24,50 доллара за грамм -
так его проще получить из урана-238, цена которого 25 USD/kg.
Но для этого нужен источник нейтронов. Таким источником могла бы быть установка,
подобная той, которой вышибали нейтроны техасским петаваттным лазером.
Схема такая: n + 238U -> 239Np -> Pu239 + n -> реакция деления + энергия.
При делении плутония-239 идёт ядерная реакция с выделением тепла:
239Pu + n -> 105Ru + 132Sn + 3n (т. е. деление ядра и разлёт осколков)
Пруф - внутри видео >>411542. Лол. Лушче источника реакции с осколками - не нашёл.
Не гуглятся чё-то осколки деления плутония-239.
Разумеется, реакцию следует проводить управляемо, с замедлением осколков,
отводом их от облучения нейтронами и поглощением их энергии.
Целевой продукт - рутений-105 распадается в родий, а затем в стабильный палладий.
105Ru(4.44(2)h, β−)105Rh(35.36(6)h, β−)105Pd(stable)
Радиоактивное олово при этом распадается так причём одни бета-лучи во всей цепи:
132Sn(39.7(8)s, β−)132Sb(2.79(5)min, β−)132Te(3.204(13)d, β−)132I(2.295(13)h, β−)132Xe(стабильный)
105Pd - составляет 29.3% природного палладия. Является стабильным изотопом и может абсорбировать водород.
Алсо, после 132Sb я вижу йодную яму, а значит внутри реакторов где она есть,
можно надыбать дофига палладия в отработанном топливе, содержащем преимущественно уран-238.
Что касается (VIII)-валентного рутения, стабильный изотоп 104Ru, как указано в примечании здесь:
https://en.wikipedia.org/wiki/Isotopes_of_ruthenium является Fission product,
и действительно, его содержание в отработанных ТВЭЛах достигает 250 граммов
на тонну «сгоревшего» ядерного топлива.
Цена рутения 42 доллара за тройскую унцию (примерно 1,35 $/г).
Также разработана технология получения рутения из технеция-99 с помощью нейтронного облучения молибдена.
Природный молибден состоит из семи стабильных изотопов:
92Мо (15,86% по массе), 94Мо (9,12%), 95Мо (15,70), 96Мо (16,50%), 97Мо (9,45%), 98Мо (23,75) и 100Мо (9,62% по массе).
Молибден, облучается нейтронами для получения молибдена-99, так растёт атомная масса молибдена.
Дальше - цепочка распада:
99Mo(2.7489(6) d, β−)99mTc(6.0058(12)h возврат к стабильному изомеру ядра)99Tc
99Tc(2.111(12)×105 аттосекунд, β−)99Ru(стабильный)
Все предыдущий изотопы молибдена - стабильны, и не распадатся при попадании в них нейтронов.
Таким образом, практически весь молибден — можно выжечь нейтронами в рутений.
Короче, по поводу водорода, я остановился на MgH2(разлагается при 287 °C) и особенно на AlH3(100 °C) из него.
Возможно его заменил бы InH3, если его можно получить из гидрида магния,
но он ещё более неустойчив (80°C), чем гидрид бериллия (125°С).
Зато индий хоть и тяжелее алюминия, но менее активен и легче плавится (156,6°C)
его можно слить при разложении гидрида, к тому же расплав индия может способствовать скорейшему его разложению.
У гидрида индия - 3 атома водорода на атом индия, также как и у Na2[ReH9] 9H/3(2Na+Re) = 3;
Интересно было бы попробовать синтезировать высший гидрид осмия, просто для изучения свойств,
а то не нашёл инфы, ну и высший гидрид рутения заодно.
И палладий, как адсорбер водорода - тоже довольно годный вариант. Ни давление, ни гидрид, ни температура не надо ему.
Поглощенный водород может быть полностью выделен из палладия путем нагревания в вакууме до 100°С.
Алсо, как я писал выше, рутений - из молибдена нейтронами,
а палладий - из урана-238 делением плутония.
Как я описал выше, палладий при распаде родия-105 получается, а этот в свою очередь - при распаде рутения-105.
Это значит, что рутений-99 из молибдена можно ещё нейтронами накачать аж до рутения-105,
и получить с него стабильный палладий-105 его распадом.
Это потому, что от 99-го рутения до 105-го изотопа все стабильны, кроме изотопа с массой 103.
https://en.wikipedia.org/wiki/Isotopes_of_ruthenium
103Ru распадается в стабильный родия-103, а он, поглощаяя нейтрон - перейдёт в стабильный палладий-104:
https://en.wikipedia.org/wiki/Isotopes_of_rhodium
Вопрос к химикам, что будет если смешать этиловый спирт с хлором?
При работе с опастными, летучими веществами амик, ртуть, метиленхлорид и так далее.
Да окислит его до альдегида, а потом начнет цепляться на енольную форму альдегида.
Как минимум еще очки.
>И еще, может кто знает состав пропитки для кислотостойких халатов?
КИСЛОТОУСТОЙЧИВОСТЬ
«БиЭМ» ЭП-42 — бесцветный двухкомпонентный эпоксидный материал с добавлением
инден-кумароновой смолы, содержащий растворители.
http://sizan54.ru/epoksidnye_materialy_biem/kislotostojkaya_propitka_biem_ep-42_dlya_betona/
мы также можем предложить ткани с масло-водоотталкивающими пропитками, тефлоновыми пропитками
и кислотоустойчивыми пропитками (Ткань "Восход" (К80) кислотостойкая 100% полиэстер плотностью 160 гр/кв.м).
http://www.balt-tex.ru/157
Защитное кислотоустойчивое покрытие получают на основе полиметакрилата и вспомогательных веществ.
Но это для капсул с лекарственными препаратами: http://www.findpatent.ru/patent/219/2198659.html
β-оловянная кислота получается в виде белого порошка при действии концентрированной азотной кислоты
на олово. Состав ее столь же неопределенен, как и состав а-оловянной кислоты.
В отличие от α-оловянной кислоты, она не растворяется ни в кислотах, ни в растворах щелочей.
Но путем сплавления со щелочами можно перевести ее в раствор в виде станната.
α-оловянная кислота при хранении ее в соприкосновении с раствором,
из которого она выделилась, постепенно тоже превращается в β-оловянную кислоту.
https://books.google.com/books?id=Sc_8AgAAQBAJ&pg=PA508
Резиновые кислотостойкие пластины производятся из резин на базе синтетических каучуков:
этилен-пропиленовых EPDM, фторкаучуков, кремнийорганических силоксановых,
бутадиен-нитрилиных NBR и др. - по технологии высокотемпературной вулканизации под избыточным давлением.
http://rezina.ru/acid-proof
Самым стойким к кислотам металлом, является иридий. До сих пор не известно ни одной кислоты или их смеси,
в которых он бы растворялся. http://veronium.narod.ru/HimRekord.htm
Для энтерального введения (кислотоустойчивы): карбенициллин (инданил натрий), карфециллин.
Из природных пенициллинов кислотостабильными свойствами, хотя и в слабой степени,
обладает только феноксиметилпенициллин (пенициллин V).
Феноксиметилпенициллин по химическому строению отличается от бензилпенициллина наличием
в молекуле феноксиметильной группы вместо бензильной.
https://www.rlsnet.ru/fg_index_id_261.htm
жирные кислоты, липоиды и восковидные субстанции благодаря йоду энергично фиксируют
амидо-фенил-метаны и образуют с краской соединения спирто- и кислотоустойчивые.
https://books.google.com/books?id=0Bz4BQAAQBAJ&pg=PT13
СИНТЕТИЧЕСКОЕ МОТОРНОЕ МАСЛО TOTAL QUARTZ 9000 5W40 API SN/CF, ACEA A3/B4 4L
Кислотоустойчивость.
http://avtokor.com/goods_info/?brand=Total&number=148597
Неоспоримым преимуществом озимой ржи является ее высокая кислотоустойчивость.
В Нечерноземной зоне страны почвы с повышенной кислотностью занимают 80% общей площади пашни.
http://sfera.fm/articles/rozh-strategicheskaya-zernovaya-kultura-v-obespechenii-prodovolstvennoi-bezopasnosti-rossii_1695
Кислотоустойчивый бетон изготавливается на основе кислотоупорного цемента, который получается из кварцевого песка
и кремнефтористого натрия. Замешивание происходит с использованием раствора натриевого жидкого стекла.
Такой цемент имеет особо высокую устойчивостью к кислотам, но очень подвержен воздействию щелочей.
http://www.sekret-remonta.ru/stroitelstvo/materiali-i-oborudovanie/tsement-samyj-vostrebyvaemyj-stroitelnyj-material.html
Эпоксидная кислотостойкая затирка Litochrom Starlike.
"Litochrom Starlike" химического концерна LITOKOL — самый современный материал для приклеивания и затирки облицовки всех типов.
Этот кислотоустойчивый материал поможет Вам в решении любых задач связанных с укладкой облицовки.
Подробнее: https://stroimag.com/n30328-epoksidnaya-kislotostojkaya-zatirka.html
Самым стойким к кислотам металлом, является иридий.
Жиры являются триглицеридами жирных карбоновых кислот (пикрелейтед).
Их разложение осуществляется под действием щелочей (омыление).
Возможно жиры будут кислотоустойчивыми ко многим кислотам, но не к концентрированной серной.
Она кислород и водород может отнять, запаковать в воду, и впитать в себя её, потому что гигроскопичность.
Кто ещё что знает кислотоустойчивое — прошу продолжить этот список.
Желательно жидкое и маслянистое... Кстати вот ещё! Тяжёлые жидкие маслянистые углеводороды, например из мазута.
Их походу, даже концентрированная серная кислота не возьмёт. Но азотная может окислить... Короче, смотрите сами...

>И еще, может кто знает состав пропитки для кислотостойких халатов?
КИСЛОТОУСТОЙЧИВОСТЬ
«БиЭМ» ЭП-42 — бесцветный двухкомпонентный эпоксидный материал с добавлением
инден-кумароновой смолы, содержащий растворители.
http://sizan54.ru/epoksidnye_materialy_biem/kislotostojkaya_propitka_biem_ep-42_dlya_betona/
мы также можем предложить ткани с масло-водоотталкивающими пропитками, тефлоновыми пропитками
и кислотоустойчивыми пропитками (Ткань "Восход" (К80) кислотостойкая 100% полиэстер плотностью 160 гр/кв.м).
http://www.balt-tex.ru/157
Защитное кислотоустойчивое покрытие получают на основе полиметакрилата и вспомогательных веществ.
Но это для капсул с лекарственными препаратами: http://www.findpatent.ru/patent/219/2198659.html
β-оловянная кислота получается в виде белого порошка при действии концентрированной азотной кислоты
на олово. Состав ее столь же неопределенен, как и состав а-оловянной кислоты.
В отличие от α-оловянной кислоты, она не растворяется ни в кислотах, ни в растворах щелочей.
Но путем сплавления со щелочами можно перевести ее в раствор в виде станната.
α-оловянная кислота при хранении ее в соприкосновении с раствором,
из которого она выделилась, постепенно тоже превращается в β-оловянную кислоту.
https://books.google.com/books?id=Sc_8AgAAQBAJ&pg=PA508
Резиновые кислотостойкие пластины производятся из резин на базе синтетических каучуков:
этилен-пропиленовых EPDM, фторкаучуков, кремнийорганических силоксановых,
бутадиен-нитрилиных NBR и др. - по технологии высокотемпературной вулканизации под избыточным давлением.
http://rezina.ru/acid-proof
Самым стойким к кислотам металлом, является иридий. До сих пор не известно ни одной кислоты или их смеси,
в которых он бы растворялся. http://veronium.narod.ru/HimRekord.htm
Для энтерального введения (кислотоустойчивы): карбенициллин (инданил натрий), карфециллин.
Из природных пенициллинов кислотостабильными свойствами, хотя и в слабой степени,
обладает только феноксиметилпенициллин (пенициллин V).
Феноксиметилпенициллин по химическому строению отличается от бензилпенициллина наличием
в молекуле феноксиметильной группы вместо бензильной.
https://www.rlsnet.ru/fg_index_id_261.htm
жирные кислоты, липоиды и восковидные субстанции благодаря йоду энергично фиксируют
амидо-фенил-метаны и образуют с краской соединения спирто- и кислотоустойчивые.
https://books.google.com/books?id=0Bz4BQAAQBAJ&pg=PT13
СИНТЕТИЧЕСКОЕ МОТОРНОЕ МАСЛО TOTAL QUARTZ 9000 5W40 API SN/CF, ACEA A3/B4 4L
Кислотоустойчивость.
http://avtokor.com/goods_info/?brand=Total&number=148597
Неоспоримым преимуществом озимой ржи является ее высокая кислотоустойчивость.
В Нечерноземной зоне страны почвы с повышенной кислотностью занимают 80% общей площади пашни.
http://sfera.fm/articles/rozh-strategicheskaya-zernovaya-kultura-v-obespechenii-prodovolstvennoi-bezopasnosti-rossii_1695
Кислотоустойчивый бетон изготавливается на основе кислотоупорного цемента, который получается из кварцевого песка
и кремнефтористого натрия. Замешивание происходит с использованием раствора натриевого жидкого стекла.
Такой цемент имеет особо высокую устойчивостью к кислотам, но очень подвержен воздействию щелочей.
http://www.sekret-remonta.ru/stroitelstvo/materiali-i-oborudovanie/tsement-samyj-vostrebyvaemyj-stroitelnyj-material.html
Эпоксидная кислотостойкая затирка Litochrom Starlike.
"Litochrom Starlike" химического концерна LITOKOL — самый современный материал для приклеивания и затирки облицовки всех типов.
Этот кислотоустойчивый материал поможет Вам в решении любых задач связанных с укладкой облицовки.
Подробнее: https://stroimag.com/n30328-epoksidnaya-kislotostojkaya-zatirka.html
Самым стойким к кислотам металлом, является иридий.
Жиры являются триглицеридами жирных карбоновых кислот (пикрелейтед).
Их разложение осуществляется под действием щелочей (омыление).
Возможно жиры будут кислотоустойчивыми ко многим кислотам, но не к концентрированной серной.
Она кислород и водород может отнять, запаковать в воду, и впитать в себя её, потому что гигроскопичность.
Кто ещё что знает кислотоустойчивое — прошу продолжить этот список.
Желательно жидкое и маслянистое... Кстати вот ещё! Тяжёлые жидкие маслянистые углеводороды, например из мазута.
Их походу, даже концентрированная серная кислота не возьмёт. Но азотная может окислить... Короче, смотрите сами...
Видео для поднятия настроения принес.
Ты наверное не в курсе, что фармацевтике тысячи лет. Я бы сам чет такое читнул, да где ж найдешь? Я ток не понимаю, нахуй она вообще кого-то бы интересовала, кроме таких аутистов, как мы с тобой.
Я тебе скажу по секрету, что не так давно лечили такой ебаной хуйней, что медицина была одной большой бабкой знахаркой, даже в так называемых цивилизованых лечебницах, как то в британской империи образца 19-го века, где врач после вскрытия трупа бежал принимать роды, быстренько помыв руки с мылом, а потом почему-то на роды в королевской больнице приходилась наибольшая смертность среди рожениц.
Не, ты не понил, мне интересна именно история эволюции в фарме.
Типа вот этого.
https://www.youtube.com/watch?v=XIL7Q3QlVKc
Я тебе выше линк дал на эволюцию в омепразол.
Можешь еще вот эту хуйню почитать, но автор описывает только часть истории, относящуюся к своей скромной жизни http://booksonchemistry.com/index.php?id1=3&category=farmacevtika&author=dayson-g&book=1964
Да ничем особо. Только химия это просто физика малых энергий. А еще среди химиков есть ебанутые, которые только под тягой умеют работать, и всё запоминают эмпирически, и всем говорят что вот они "тру химики". А всё остальное недостойное говно. С такими лучше не общаться, серьезно.
Да, а есть норм химики, которые работают только с мамкой дома. Прям как ты, да? Химия воспроизводима только там, где эксперимент, окай? Ты что угодно можешь считать, но если твои расчеты не основаны на эксперименте, но не имеют отношения к реальному миру и опровергаются им в эксперименте.
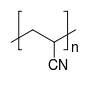
Одно дело обобщать и разрабатывать теорию на экспериментальных данных. А другое дело, бездумно повторять методики, и эмпирически запоминать продукты. Или бездумно подбирать условия, а потом гордиться что брутфорсом что-то синтезнул.
Что это ты так подгорел? Неужто ты говновар?
(надо понимать что против синтетиков, которые знают что делают, никогда ничего не имел.
А против говноваров, которые не могут объяснить что происходит у них под тягой, да)
Причем первые всегда уважительно относятся к другим, а вторые нет.
Я наверное не понял тебя. Анализ эксперимента нужен, безусловно. Я просто не понял, что значит "только под тягой умеют работать". Мы имеем одинаковое мнение, на самом деле.
Но я столкнулся с проблемой, что метилцеллюлоза почему-то не продается. Совсем. Кто-то продает гидроксипропилцеллюлозу под названием метилцеллюлоза, а на самой упаковке написано "cellulose ether". Штослучилося? Экологи заебали химиков и заставили снижать до нуля выбросы хлорметана? Это удивительно, учитывая тот факт, что для производства карбоксиметилцеллюлозы используется фосген.
Как преобразовать электрическую энергию в химическую, например в топливо?
Интересует именно жидкое топливо, которое можно было бы наработать в вот таких вот солнечных электростанциях:
>>413255>>413262
Нашёл только процесс Фишера-Тропша, дополненный электролизом в подразделе "Дизель из воды", в статье:
http://www.dsnews.ua/future/toplivnaya-problema-reshena-uchenye-zalyut-mir-deshevym-ekologichnym-11122014124300
Там используется, по всей видимости реакция с атмосферным углекислым газом:
CO2 + 2 H2 <=> CO + 2 Н2O, которая обратима, к тому же угарный газ - ядовит.
При этом, CO + H2O -> CO2 + H2 при t>830 °C, и идёт конверсия,
А вот при t<830 °C; CO2 + H2 -> CO + H2O, т. к. ниже 830 °C
более сильным восстановителем является CO, — выше 830 °C — водород.
Конверсию окиси углерода применяют преимущественно для производства водорода при 400-450С
и повышенном давлении и с большим переизбытком водяного пара. В процессе выделяется доп. энергия:
CO + 2 Н2O -> CO2 + 2 H2 + 42 МДж
при понижении температуры и давления начинается обратный процесс
CO2 + 2 H2 -> CO + 2 Н2O
Однако это всё слишком сложно, и на мой взгляд — проще центрифугировать в нефть хлореллу: >>412751 >>412776 >>412777
А её - на солнышке выращивать, к тому же воду с CO2 ей подавай.
Меня доебала эта беготня за энергоносителями, еси честно. Рашка еще лет 50 минимум будет сидеть на ископаемом горючем, которое всегда будет дешевле синтетического, так что расслабься и не парься.
Меня больше умиляет, как чувак спрашивает просто безумно глобальные идеи, тут в тредике, при этом вообще не зная химию, и срет инфой зачем-то.
Скоро начнет делать вот так "ребят ребят, слушай кто подскажет лекарство от спида"
"ребят, смотрите что придумал, помогите, хочу старение выключить"
"ребят ребят, придумал как справиться с глобальным потеплением, оцените"
Я от него в ахуе. Особенно с его идей, аля 6 класс.
Ты только на потребление рассчитываешь.
Эти 50 лет быстро пролетят.
А надо будет ещё ресурсы приберечь, чтоб на Марс пиздовать после терраформинга.
Размеры Солнца вырастут как минимум в 200 раз, то есть почти до современной земной орбиты (0,93 а.е.) Меркурий и Венера,
несмотря на сильную потерю массы Солнца к моменту перехода на стадию красного гиганта,
будут им поглощены и полностью испарятся. Земля, если не разделит их судьбу, будет разогрета настолько,
что шансов на сохранение жизни не будет никаких.
Океаны же испарятся задолго до перехода Солнца на стадию красного гиганта, приблизительно через 1,1 миллиарда лет.
>>413284
>Меня больше умиляет, как чувак спрашивает просто безумно глобальные идеи, тут в тредике,
Какие такие глобальные? Вполне себе обыденные, дабы разобраться.
>при этом вообще не зная химию,
С чего взял?
>и срет инфой зачем-то.
Ну, чтобы перепроверить так ли это, и организовать на этих принципах - коллаборации из корпораций!
>Скоро начнет делать вот так "ребят ребят, слушай кто подскажет лекарство от спида"
Уже есть. >>404421>>404471 и тут, внизу посмотри: >>404479 (OP)
Алсо, АРВТ: «Зидолам» (зидовудин+ламивудин) + «Эфавиренз».
>"ребят, смотрите что придумал, помогите, хочу старение выключить"
CRISPR/Cas9, теломераза, удлиннение теломер, стволовая терапия, иммортализация соматических клеток.
>"ребят ребят, придумал как справиться с глобальным потеплением, оцените"
Вот тут посмотри: >>413154
Там, кстати, при попадании альфа-частиц в ядро азота-15 будет идти реакция во фтор:
A weak resonance at 850 keV in 15N(α,γ)19F corresponding to a level at 4681 ± 1 keV
а он ядовит, но всё равно его можно осадить в магний - сначала вот так: 19F(α, p)22Ne,
а потом так: 22Ne(α,n)25Mg, 22Ne(α, γ)26Mg. Оба изотопа магния стабильны.
Всё это образуется при последующем облучении теми же альфа-частицами.
>Я от него в ахуе. Особенно с его идей, аля 6 класс.
Каких именно идей, интересно?
>>413285
Сам себя игнорируй. Как ты - так тебе.
Ты только на потребление рассчитываешь.
Эти 50 лет быстро пролетят.
А надо будет ещё ресурсы приберечь, чтоб на Марс пиздовать после терраформинга.
Размеры Солнца вырастут как минимум в 200 раз, то есть почти до современной земной орбиты (0,93 а.е.) Меркурий и Венера,
несмотря на сильную потерю массы Солнца к моменту перехода на стадию красного гиганта,
будут им поглощены и полностью испарятся. Земля, если не разделит их судьбу, будет разогрета настолько,
что шансов на сохранение жизни не будет никаких.
Океаны же испарятся задолго до перехода Солнца на стадию красного гиганта, приблизительно через 1,1 миллиарда лет.
>>413284
>Меня больше умиляет, как чувак спрашивает просто безумно глобальные идеи, тут в тредике,
Какие такие глобальные? Вполне себе обыденные, дабы разобраться.
>при этом вообще не зная химию,
С чего взял?
>и срет инфой зачем-то.
Ну, чтобы перепроверить так ли это, и организовать на этих принципах - коллаборации из корпораций!
>Скоро начнет делать вот так "ребят ребят, слушай кто подскажет лекарство от спида"
Уже есть. >>404421>>404471 и тут, внизу посмотри: >>404479 (OP)
Алсо, АРВТ: «Зидолам» (зидовудин+ламивудин) + «Эфавиренз».
>"ребят, смотрите что придумал, помогите, хочу старение выключить"
CRISPR/Cas9, теломераза, удлиннение теломер, стволовая терапия, иммортализация соматических клеток.
>"ребят ребят, придумал как справиться с глобальным потеплением, оцените"
Вот тут посмотри: >>413154
Там, кстати, при попадании альфа-частиц в ядро азота-15 будет идти реакция во фтор:
A weak resonance at 850 keV in 15N(α,γ)19F corresponding to a level at 4681 ± 1 keV
а он ядовит, но всё равно его можно осадить в магний - сначала вот так: 19F(α, p)22Ne,
а потом так: 22Ne(α,n)25Mg, 22Ne(α, γ)26Mg. Оба изотопа магния стабильны.
Всё это образуется при последующем облучении теми же альфа-частицами.
>Я от него в ахуе. Особенно с его идей, аля 6 класс.
Каких именно идей, интересно?
>>413285
Сам себя игнорируй. Как ты - так тебе.
Это у тебя скорее шизофазия, а я вполне себе последовательно излагаюсь. Всё, а терь пшёл вон.
>излагаюсь
Наверни вот этого: http://www.morfologija.ru/словоформа/излагаясь
>И правда шизофазия, построение фраз характерное.
При шизофазии нарушена связность речи, как у тебя прям...
А теперь смотри сюда, долбоеб - это химии тред. Здесь беседы о химии, вопросы и ответы.
Ты же лезешь не в тему, цитируешь огромную пачку постов, и как-бы доябуясь - поришь какую-то
припиздекнутую хрень в своём неинформативном высере - огребая при этом, за это пизды.
Единственный аргумент твой это какой-то курлык в адрес личности, и заезженная вебм-ка про шизофазию,
которую ты спамишь из треда в тред, кому попало, с дебильным вопросом в довесок вида:
"уроки-то сделал", и про мамаш что-то там ещё кудахчешь.
А теперь, блядь после всего этого, пиздуй лучше качать словарь Даля и импульсы учить, долбоёба кусок, сажа-скрыл.
А будешь выёбываться - найду по спутнику, по координатам, через IP tracert.
Ок, скрыл тебя.
А словарь Даля бесплатно скачать можно, вперёд.

Забавно но в комментах там где просят посоветовать вещества количество любителей этанола преобладает над любителями кофе примерно 1к4 судя по лайкам. Связано ли это с тем что производители неверно ипросто непонятно указывают дозировки? Например на моем кофе написано 2чл на порцию, это примерно 100-120мкг кофеина, этого недостаточно даже для 50кг тян, это количество для ребенка. В те же энерджи дринках примерно 150мкг кофеина на банку, это минимум для 50кг тян, а мне надо 2 таких банки или даже 3. Тоже самое касается инструкций к мед препатам, там указана какая-то абстрактная средняя дозировка, например на пирацетаме учитывая его его плохую проходимость через гэб она занижена до не эффективной, можно конечно сказать что есть фенилпирацетам но он дорогой и там дозировки тоже занижены. Это производители так страхуются или что? В чем сложность указывать дозировку с учетом веса? Понимаю что это шульгинизм и вообще недоступно большинству обывателей шаманство, но все же зачем так жить?
Ебаныврот, чел переводит уксусный ангидрид на ацетилирование сраного анилина. Чтоб я так жил, чтоб я растворители алюмогидридом сушил, а диэтиловым эфиром посуду мыл. В коментах тоже охуевают от этого.
Я не знаю, как относятся этанол и кофеин к теме видео.
Кофеин - это сраное короткодействующее говно, но его, к тому же, еще и почти нет в растворимом кофе. Если ты нахуяришься этим кофем, то через 30-60 минут заснешь нахуй, и чем больше въебешь, тем сильнее заснешь. Так долбоебы садятся за руль и разбиваются через 50 км. Энерджи дринками вообще свою жену беременую кормить будешь.
>на пирацетаме учитывая его его плохую проходимость через гэб она занижена до не эффективной
https://ru.wikipedia.org/wiki/Пирацетам
"В результате суммарного анализа данных 24 исследований c 11959 участниками было показано, что пирацетам не приводит к достоверному улучшению состояния больных деменцией, включая сосудистую и вызванную болезнью Альцгеймера, а также к улучшениям при когнитивных нарушениях, по сравнению с плацебо[6]. Авторы обзора делают вывод о необходимости дальнейшего изучения препарата."
Вот я и справшиваю: нахуй ты живешь? Каково это - жить и потреблять информационый кал?
Справочник растворимости - Коган
Handbook of Aqueous Solubility Data -Yalkowsky
Solubilities of inorganic and organic substances - Seidell
>>413331
>переводит уксусный ангидрид на ацетилирование сраного анилина. Чтоб я так жил, чтоб я растворители алюмогидридом сушил, а диэтиловым эфиром посуду мыл.
>Кофеин - это сраное короткодействующее говно
Стало очевидно что он просто нарик упоротый по самые помидоры. Не может удержать тему в голове и пишет чисто поток своего говна из головы, а простыни судя потому что он принял что-то стимулирующее.
>чел переводит уксусный ангидрид
>Чтоб я так жил
Так говоришь, как будто его сложно получить из той же уксусной кислоты, посредством образования кетена или же кетен пиролизом ацетона в «кетеновой лампе».
Да даже так, пик2.
Кучу людей кусают локти, потому что уксусный ангидрид весьма проблематично раздобыть, ровно как и сделать самому. Чел им разбрасывается просто так, для субстрата, для которого он и не нужен вовсе. Это вроде видосов про реакцию брома с айфоном, где спецом подчеркивается, что айфон новенький, только что купленый, рабочий, вот я его кидаю в бром, и ух ты, какая красивая реакция.
>>413336
Прикинь, как все хуево, учитывая то, что я ничего не употребляю. В отличие от вас. Если вокруг шизики, то лечиться нужно тебе. Таблетки принял свои?
>>413337
Сколько раз ты пиролизовывал в кетеновой лампе? Много вас таких по весне оттаяло.
>Вретии я не обосрался, мне подложили говно в штаны
Шизик обрекает окружающих в том что он шизики.
Ну может ты не шизик, а просто даун. Чего это я, в самом деле, грешно смеяться над юродивыми.
Теперь смотри сюда, и осознавай, какое ты говно: http://www.prepchem.com/synthesis-of-acetanilide/

Понарожают хуйни, а потом смотри их видео. Как грит автор видео "почти как в оригинальной статье".

>Сколько раз ты пиролизовывал в кетеновой лампе? Много вас таких по весне оттаяло.
Вообще-то кетен из уксусной кислоты тоже, походу - в кетеновой лампе делается.
>стадия протекает в газовой фазе при температуре 700—750 °С
>в присутствии следовых количеств триэтилфосфата.
Поэтому можно вот так:
уксусная кислота (нейтрализация) => ацетат натрия (сплавление со щёлочью) =>
метан (галогенирование на свету) => хлорметан (щелочной гидролиз) => метанол (окисление)
Дальше, метилацетат: CH3OH + CH3COOH = CH3COOCH3 + H2O;
И карбонилирование его в присутствии родиевого катализатора, пикрелейтед.
Алсо, остатки спирта при карбонилировании уйдут в кислоту: CH3OH + CO → CH3COOH
Ну и этанол в смеси метанола можно получить из метилацетата его гидрированием:
CH3COOCH3+2H2 -> CH3CH2OH + CH3OH;
Угомони свою шизофазию.
Ты понимаешь, что химическая реакция если есть, это еще не значит, что её можно провести. Люди порой пишут реакции с выходом в 1%.
Я просто в лабе работаю, где растворители дейтерированные. Поэтому всю боль не прочувствовал. Хотя да, надо экономить. Мне рассказали как одна балда, вместо того чтобы проверить растворимость соединений в обычных растворителях, перепутала и проверяла на дейтерированных. Лел.

>уксусный ангидрид весьма проблематично раздобыть
1. Ca(OH)2 -> CaO + H2O - прокаливание;
2. CaO + 3C -> CaC2 + CO - карбид кальция;
3. CaC2 + H2O -> Ca(OH)2 + C2H2↑ - ацетилен;
4. Дальше - реакция Кучерова (Hg2+,H+): C2H2+H2O -> CH3CHO - ацетальдегид.
5. И вот: https://ru.wikipedia.org/wiki/Уксусный_ангидрид#.D0.9E.D0.BA.D0.B8.D1.81.D0.BB.D0.B5.D0.BD.D0.B8.D0.B5_.D1.83.D0.BA.D1.81.D1.83.D1.81.D0.BD.D0.BE.D0.B3.D0.BE_.D0.B0.D0.BB.D1.8C.D0.B4.D0.B5.D0.B3.D0.B8.D0.B4.D0.B0
Только тут надо быстро воду удалять. Чем не знаю, походу оксидом фосфора P2O5.
Но это целая установка. Лучше, ацетат алюминия, он при прокаливании разлагается на ангидрид и оксид алюминия.
Если ацетат основного метала-при прокаливании дает ацетон и карбонат металла. Если амфотерного - то ангидрид и оксид металла.
Тогда есть сажа, потом можешь скрыть пост, и зарепортить, а потом закрыть двач
и даже абузу на домен намутить, лол.
Дейтрированые растворители, хоть и очень дорогие, не представляет проблемы приобрести, не приобретя попутно проверки контролирующих органов, как это случается с тионил хлоридом (OPCW) или уксусным ангидридом (ФСКН). Некоторые из этих ребят решительно ничего не понимают в химии, и это не их проблема. То есть, можешь сразу прибавлять к стоимости еще и взятки.
Ты реально думаешь, что кто-то из ФСКН пойдет в РАНовский институт? Воу. чет бред.
Тем-более. И хер ли ты обзываешься, за криминальными сводками не слежу,телевизора вообще нет.
Нахуй иди, дебил.
В РАН сидят одни мудаки и корупционеры, туда не пойду я. А все остальные попадают под раздачу от контролирующих органов, которые уже очень давно живут на одних необоснованых наездах, и честно оформить что-то стало чем-то мифическим: либо ты заносишь кому надо, либо твою парашу закроют. Знакомый строил дом в москве, спустя 2 года после старта строительства заложили фундамент - зато честно все, по закону.

>В РАН
>Знакомый строил дом в москве
А еще вокруг одни пидоры, знакомый ходил в гейклуб и его там выебали.
Ты где живешь вообще? Ты паспорт за сколько дней оформил? Сколько потратил часов на оформление водительских прав? Охуевшие продажные чинуши - это абсолютное правило для всех регионов.
Я хочу увидеть такого чинуша. Его нужно в музей и показывать всем, мол "Иванов Иван, гос служащий, который честно выполняет свои обязанности". По-моему они уже вымерли все такие, как динозавры.
Надо просто немного отсосать. Ты ради удобства не сможешь? Это же просто.
whatever google brings.
А хуй знает, вангую только всякое древнее пресное дерьмо типа этих:
http://www.fptl.ru/biblioteka/pharmacology.html
Сам не химик, надо студней спрашивать.

Значит придется чистить вилкой старые книги по фарме.
А я тебе что пишу? Ну типа да, в детстве когда-то я и сам смешивал вся кую хуйню вместе и наблюдал что происходит. Но мне не приходило на ум это выкладывать на ютьюб.
Я в детстве только пиво с водкой любил смешивать.
"Пришел к вам за советом по поводу книги по футболу для себя долбаеба ибо со школы вообще ничего не помню". Ну ты понел. Если человек пишет книгу обо всем и ни о чем, то он мудак изначально, тут уже не важно, что будет в книге.
Есть такая, но я тебе её ясно не посоветую. Не втащишь. А вот учебник Зайцева посоветую.
http://www.twirpx.com/file/1427876/grant/
Если ты долбоеб то химия не для тебя. Ты хочешь для себя учить я так понимаю? Если ты реально не очень то это все может плохо для тебя кончится, в лучшем случае ты останешься без пальца, в худшем случае может пострадать кто-то еще с летальным исходом. Не надо, займись лучше математикой, отличная наука, сложная и вреда своими расчетами ты вряд ли сможешь нанести.
>sigmaaldrich
Ебать ты конч. Дейтерорастворители производятся в Роиссе и стоят здесь в два раза дешевле. Кроме этого, сигма - самый ебанутый по ценам магазин, они разъезжают по всем институтам и кукарекают про скидки для руководителей проектов и прочую хуйню, но даже со всеми возможными скидками купить в сраной альфе через реакор оказывается в среднем на треть дешевле, чем без посредников в сигме.
Ефёсты от журналов.
И математику хочу вспомнить и физику и химию, лазаю по разделам и в инете и ищу книги для того что бы создать фундамент. Ничего противозаконного или опасного и к сожалению без опытов. Я же говорю что мне нужны основы
Глинка.
H+ это и есть протон. Но например в водных растворах(очевидно что) это H3O+. Просто химики договорились, мол писать просто H+, для краткости уравнений.
Марганец посмотри, или высшие фториды переходных металлов.
Вот тут посмотри: https://ru.aliexpress.com/item/1000g-Food-Additive-Monosodium-Glutamate-E621-MSG-Flavour-Enhancer-Seasoning/32729755935.html?spm=2114.41010308.4.8.Zp3mDx
Глутамат натрия (лат. natrii glutamas, англ. monosodium glutamate, глютаминат натрия) — мононатриевая соль глутаминовой кислоты, популярная пищевая добавка E621 (в этом качестве также называется «усилитель вкуса»).
Представляет собой белый кристаллический порошок, хорошо растворимый в воде.
Растворяешь, фильтруешь и кристаллизируешь.
Можешь ещё и расплавить при 165 °C, чтобы он вытек из кристаллов.
Но сильно не нагревай, потому что температура разложения 225 °C.
Ты же его не есть собираешься, да?
В азиатских магазинах продаётся чистый пищевой глутамат как приправа в пакетиках. Осталось только найти магазин.
https://yadi.sk/i/pPz3swrjtV262
Ну, попробуй Лидина. Я в своё время с него начинал. Только органика в этом справочнике скудно расписана, но поначалу её много и не надо.
>В азиатских магазинах продаётся чистый пищевой глутамат как приправа в пакетиках. Осталось только найти магазин.
Можешь синтезировать её из глютена (клейковины), только понадобится соляная кислота.
Клейковина - это белковое вещество, содержащееся в хлебном зерне, а также в семенах злаковых растений,
в особенности пшеницы, ржи и ячменя.
Метод - описан тут: http://zozhnik.ru/naturalnyjj-vs-iskusstvennyjj-glutamat/
>её
Имеелась в виду глютаминовая кислота. А тебе же надо её натриевая соль.
Содой посыпь её, короче в растворе, должна будет походу прореагировать с выделением углекислого газа.
Или щёлочью натриевой. Что ещё?.. Да, сама кислота кстати, горит вроде-бы с выделением аммиака или оксида азота:
C5H9NO4 + O2 = H2O + CO2 + NH3;
C5H9NO4 + O2 = CO2 + H2O + N2;
C5H9NO4 + O2 = CO2 + H2O + NO2;
Вот такие реакции нагуглил. Как сожжёшь её - отпиши тут, что за газ выделяется, ок? В википедию занесу.
В китайских и японских магазинах продается килограммами в пакетах. Сам лично покупаю.

Можешь растворить этот свой глутамат натрия в воде,
потом залить соляной кислотой,
и получить кристаллы глутаминовой кислоты в растворе соли:
С5H8NO4Na + HCl -> С5H9NO4 + NaCl;
В химически чистом виде глутаминовая кислота имеет вид белых или бесцветных кристаллов
без запаха, имеющих кислый вкус, в воде кристаллы растворяются плохо.
Значит она уйдёт в осадок.
А потом - можешь разложить её, ну тоесть сжечь в кислороде или на воздухе.
Если почуешь запах аммиака - значит NH3, или увидишь бурый газ - значит NO2,
иначе N2 выделяется при её горении.
А потом можешь сюда отписать, а то нихрена же не с выделением какого газа она сгорает.
Саму соляную кислоту можешь получить растворением хлороводорода в воде.
Хлороводород же можешь получить из хлора и водорода, а их - в результате электролиза.
Реакция хлора с водородом и образование хлороводорода идёт на свету.
H2 + Cl2 -> 2HCl;
С хлором водород соединяется при нагревании,
на свету же реакция проходит даже при нормальной температуре со взрывом (хлопком).
Водород горит в хлоре зелёным пламенем.
https://www.youtube.com/watch?v=vlpK-i-7-Bk
А смотрите что надыбал глютаминовая кислота из глюкозы:
C6H12O6 + NH3 + 3/2 O2 ---> C5H9NO4 + CO2 + 3H2O
Что за шизовазию ты несешь в каждом треде. Почему бы тебе не пойти учиться в универ, чтобы не срать очевидной хуитой.
репорт тебя, заебал.
>Если не врубаешься - поясню.
Есть глутамат натрия. И есть глутаминовая кислота.
Она - горит и при сгорании выделяет помимо воды и углекислого газа - ещё один газ.
Это либо аммиак, либо оксид азота, либо просто азот.
Я не знаю какой газ, и не имел дело с чистой глутаминовой кислотой,
но предлагаю её получить и сжечь её тем, у кого есть этот глютамат натрия.
Это ноотроп кстати, походу.
В медицине применение глутаминовой кислоты оказывает незначительное психостимулирующее,
возбуждающее и ноотропное действие, что используют в лечении ряда заболеваний нервной системы.
В середине 20 века врачи рекомендовали применение глутаминовой кислоты внутрь в случае
мышечно-дистрофических заболеваний. Также её назначали спортсменам с целью увеличения мышечной массы.
А реакция получения глютаминовой кислоты при взаимодействии глюкозы с аммиаком и кислородом -
отсюда: http://www.chemicalforums.com/index.php?topic=16845.0
Эта реакция имеет микробиологический характер и протекает внутри иммобилизованных клеток
генетически улучшенного штамма бактерий Brevibaterium lactofermentum.
А теперь, пошёл вон из треда, если не шаришь нихуя в формулах - не лезь в химии тред,
и уж по теме ничего не подпёздывай если разобраться не можешь, и к личности цепляться нехуй, понял?
Анус себе зарепорть, пёс.

+2 или +4 ?
Или это два разных соединения?
https://pubchem.ncbi.nlm.nih.gov/compound/pyrite
https://chem.nlm.nih.gov/chemidplus/rn/12068-85-8
Ёбаная неорганика

С точки зрения неорганической химии, которая определяет степень окисления каждого атома, формулу пирита лучше всего записать как Fe(2+)S2(2-). Этот формализм показывает, что атомы серы в пирите находятся в парах S—S. Эти единицы персульфидов в пирите можно рассматривать как полученные от персульфида водорода (химическая формула H2S2, структурная H—S—S—H). Таким образом пирит следовало бы более правильно называть персульфид железа, а не дисульфид железа.
Формальная степень окисления в пирите для железа равна +2, а для серы -1.
Да обычные ящерки, змеи тоже, специфический их пресмыкающийся запах. Иногда кожа моя также начинает пахнють, хочу разобраться
Ну, не сильно пресмыкайся, значит.

>>414150
В следующий тред, помимо годных пикчей - прицепите ещё
хорошую таблицу Менделеева в высоком разрешении, как на пикрелейтед.
И ссылку на расширенную таблицу химических элементов:
https://ru.wikipedia.org/wiki/Расширенная_периодическая_таблица_элементов
где есть Унбигексий.
Пили перекат, я тебя благославил.
Только добавь в шапку Глинку, типа кто будет спрашивать какую книгу первую почитать вспомнить химию.
Готово. >>414180 (OP)
Тред с мочой можно сносить. >>414148 (OP)
ПЕРЕКАТ.
https://2ch.hk/sci/res/414180.html (
https://2ch.hk/sci/res/414180.html (
https://2ch.hk/sci/res/414180.html (
https://2ch.hk/sci/res/414180.html (
https://2ch.hk/sci/res/414180.html (
https://2ch.hk/sci/res/414180.html (
https://2ch.hk/sci/res/414180.html (
https://2ch.hk/sci/res/414180.html (
https://2ch.hk/sci/res/414180.html (
https://2ch.hk/sci/res/414180.html (
https://2ch.hk/sci/res/414180.html (
https://2ch.hk/sci/res/414180.html (
https://2ch.hk/sci/res/414180.html (
https://2ch.hk/sci/res/414180.html (
Прикольный гет.
Этот словил гет в пентипл.

Вы видите копию треда, сохраненную 27 октября 2017 года.
Можете попробовать обновить страницу, чтобы увидеть актуальную версию.
Скачать тред: только с превью, с превью и прикрепленными файлами.
Второй вариант может долго скачиваться. Файлы будут только в живых или недавно утонувших тредах. Подробнее
Если вам полезен архив М.Двача, пожертвуйте на оплату сервера.