Вы видите копию треда, сохраненную 8 февраля 2018 года.
Можете попробовать обновить страницу, чтобы увидеть актуальную версию.
Скачать тред: только с превью, с превью и прикрепленными файлами.
Второй вариант может долго скачиваться. Файлы будут только в живых или недавно утонувших тредах. Подробнее
Если вам полезен архив М.Двача, пожертвуйте на оплату сервера.
Кто хочет вспомнить химию или ищет книгу - тут вот посоветовали "Общая химия. Глинка Н.Л".
Скачать в PDF можно здесь (44,1 МБ): http://www.200ballov.com.ua/files/chem/glinka.pdf
Вот пару картинок с таблицами Менделеева. Пик4 - цикл Кребса.
Вот ещё пикча побольше, кому для плакатов - она сюда просто не лезет:
http://ogoom.com/uploads/posts/2011-05/ogoom.com_1305370963_mendeleev1.jpg
Также оставлю здесь расширенную таблицу химических элементов, где есть даже Унбигексий:
https://ru.wikipedia.org/wiki/Расширенная_периодическая_таблица_элементов
И ссылку на таблицу нуклидов на английской википедии, там видно типы распадов:
https://en.wikipedia.org/wiki/Table_of_nuclides_(segmented,_narrow)
https://en.wikipedia.org/wiki/Category:Lists_of_isotopes_by_element
Потому что здесь: https://ru.wikipedia.org/wiki/Таблица_нуклидов
По каждому конкретному элементу это поле нужно допиливать.
https://ru.wikipedia.org/wiki/Шаблон:Периодическая_таблица_по_изотопам_элементов
Вот, например можно сравнить внизу таблицы:
https://ru.wikipedia.org/wiki/Изотопы_кислорода
https://en.wikipedia.org/wiki/Isotopes_of_oxygen - тут видно тип распада, каналы распада и вероятность.
К чему твой высер? Иди броди.
Что за элемент? Коперниций или лютеций? Полагаю первый.
>в Германии лютеций долгое время называли кассиопий и обозначали его символом Cp.
>Учёные GSI предложили для 112-го элемента название Copernicium (Cn) в честь Николая Коперника.
>Первоначально предложенный первооткрывателями символ Cp был признан неподходящим.
>в Германии лютеций долгое время называли кассиопий и обозначали его символом Cp
>Ранее для него предлагались названия штрассманий St, венусий Vs, фриший Fs,
>гейзенбергий Hb, а также лаврентий Lv, виксхаузий Wi, гельмгольций Hh.
Ядро наиболее стабильного из его известных изотопов, 285Cn,
состоит из 112 протонов, 173 нейтронов и имеет период полураспада около 34 секунд,
атомная масса этого нуклида равна 285,177(4) а. е. м.
Ядерных изомеров этот изотоп не имеет.
Однако ядерные изомеры имеет изотоп коперниция с атомной массой 283.
https://en.wikipedia.org/wiki/Isotopes_of_copernicium
И как видишь, время жизни изомера 283m более длительное, и составляет около 5-ти минут.
Это наибольшее время жизни коперниция среди всех прочих изотопов.
Что касается Лютеция, который раньше кодировался символом Cp (кассиопий):
Природный лютеций состоит из двух изотопов: стабильного 175Lu (изотопная распространённость 97,41 %)
и долгоживущего бета-радиоактивного 176Lu (изотопная распространённость 2,59 %,
период полураспада 3,78·1010 лет), который распадается в стабильный гафний-176.
И как ты можешь видеть здесь: https://en.wikipedia.org/wiki/Isotopes_of_lutetium
Ни один из его ядерных изомеров не является более стабильным основного нуклида.
Разве что между 177Lu и 177m3Lu достаточно большой разброс.
Подробнее о ядерных изомерах - можешь глянуть тут:
https://ru.wikipedia.org/wiki/Изомерия_атомных_ядер
Что за элемент? Коперниций или лютеций? Полагаю первый.
>в Германии лютеций долгое время называли кассиопий и обозначали его символом Cp.
>Учёные GSI предложили для 112-го элемента название Copernicium (Cn) в честь Николая Коперника.
>Первоначально предложенный первооткрывателями символ Cp был признан неподходящим.
>в Германии лютеций долгое время называли кассиопий и обозначали его символом Cp
>Ранее для него предлагались названия штрассманий St, венусий Vs, фриший Fs,
>гейзенбергий Hb, а также лаврентий Lv, виксхаузий Wi, гельмгольций Hh.
Ядро наиболее стабильного из его известных изотопов, 285Cn,
состоит из 112 протонов, 173 нейтронов и имеет период полураспада около 34 секунд,
атомная масса этого нуклида равна 285,177(4) а. е. м.
Ядерных изомеров этот изотоп не имеет.
Однако ядерные изомеры имеет изотоп коперниция с атомной массой 283.
https://en.wikipedia.org/wiki/Isotopes_of_copernicium
И как видишь, время жизни изомера 283m более длительное, и составляет около 5-ти минут.
Это наибольшее время жизни коперниция среди всех прочих изотопов.
Что касается Лютеция, который раньше кодировался символом Cp (кассиопий):
Природный лютеций состоит из двух изотопов: стабильного 175Lu (изотопная распространённость 97,41 %)
и долгоживущего бета-радиоактивного 176Lu (изотопная распространённость 2,59 %,
период полураспада 3,78·1010 лет), который распадается в стабильный гафний-176.
И как ты можешь видеть здесь: https://en.wikipedia.org/wiki/Isotopes_of_lutetium
Ни один из его ядерных изомеров не является более стабильным основного нуклида.
Разве что между 177Lu и 177m3Lu достаточно большой разброс.
Подробнее о ядерных изомерах - можешь глянуть тут:
https://ru.wikipedia.org/wiki/Изомерия_атомных_ядер
Ты потроллить так решил?или реально школота? Это обозначение циклопентадиенила (С5H5)-
А Cp* это пентаметилциклопендадиенил.
Кстати, чем проверять степень полимеризации можно? Чем проще всего в лабе это делают?
Вот в свойствах глутамата натрия написано что он не растворим в эфире. Пойдет ли петролейный эфир чтобы растворить жиры из кубиков?
>Чем проще всего в лабе это делают
ну находят на гель-проникающей хроматографии молекулярную массу полимера и прикидывают
Что мешает отвечать на поставленный вопрос вместо того чтобы щитпостить?
![img-TBqHWY[1].png](/sci/big/thumb/414180/14966204865330s.jpg) 4 Кб, 545x302
4 Кб, 545x302>Вот в свойствах глутамата натрия написано что он не растворим в эфире.
Глутамат натрия представляет собой белый кристаллический порошок, хорошо растворимый в воде.
>Пойдет ли петролейный эфир чтобы растворить жиры из кубиков?
Если ты залил жиром глутамат натрия, проще залить его водой и растопить жир.
Глутамат уйдёт в раствор, а жир - на поверхность всплывёт.
Снизу - можешь слить раствор и выкристаллизировать этот свой глутамат.
Петролейный эфир из легких алифатических углеводородов состоит же (пентанов и гексанов).
Как минимум - запачкает глутамат натрия, как максимум ещё и прореагировать может.
Поэтому лучше не юзать. Хотя жиры он растворяет хорошо...
Но нахрена тебе глютамат в растворе жира? Ты так его кристаллизировать оттуда собрался, что-ли?..
Ааа, так ты из кубиков хочешь его доставать?.. Там жир (подсолнечное масло) не единственная примесь.
Там помимо глутамата ещё много всякого всего... http://lentorg24.ru/catalog/product/33040000.html
Состав: йодированная соль, усилители вкуса и аромата (глутамат натрия Е621, инозинат натрия Е631),
мальтодекстрин, сахар, экстракт растительных белков, подсолнечное масло, куриное мясо,
овощи (петрушка, сельдерей, лук, морковь), идентичный натуральному и натуральный ароматизаторы (курица, перец),
куркума, экстракт специй (карри), краситель (рибофлавин Е101), антиокислитель (бутилгидроксианизол Е320).
Мальтодекстрин растворяется в воде. Температура плавления 85 °С.
бутилгидроксианизол не растворяется в воде.
Рибофлавин слабо растворим в воде: 0,11 мг/мл при 27,5 °C
Экстракты и ароматизаторы - возможно растворимы. Петрушку, мясо - фильтровать придётся.
Инозинат натрия - хорошо растворяется в воде. Температуру плавления его не нашёл.
Короче, получив раствор инозината натрия и глутамата натрия, и кристаллы их - возможно из этой смеси
тебе удастся выделить глутамат натрия плавлением этого глутамата или же плавлением инозината натрия
- если его температура плавления меньше, а температура разложения - выше температуры плавления глутамата натрия.
Глутамат натрия плавится при 165 °C, но при 225 °C он уже разлагается - поэтому для плавления
и вытекания глутамата нагревать его кристаллы нужно равномерно, и не очень интенсивно.
На тебе, раз дрочишь на эти циклопентадиенилы:
http://www.vesti.ru/doc.html?id=2893672&cid=2161
Как это связано с магнитным моментом комплекса?то что ты кинул, обычная новость, причем в составе даже нет металла.
Просто увидел, вспомнил твой пост и закинул.
Магнитный момент - не спин, это раз, а во вторых звёздочку я проинтерпретировал
как возбуждённое ядро какого-то там атома. Всё, вали.
цп* более донорный, у него взмо выше по энергии, следовательно вызывает большее расщепление d уровней, поэтому комплекс низкоспиновый. но это не точно.
 15 Кб, 453x418
15 Кб, 453x418>Да, ты верно написал, у него ВЗМО выше, и как правило ВЗМО ниже чем d уровни металла, поэтому любое повышение будет улучшать резонансный интеграл.
а вот и картиночка с гугла подъехала
Там единственное опечатка в названии разрыхляющейтам e1g надо, а не e1u , а в целом картинка вроде норм.
 523 Кб, 2560x1920
523 Кб, 2560x1920Маслянный насос. Ну тебе он разве что в жопу посовать.
![0059-1[1].png](/sci/big/thumb/414180/14968932991570s.jpg) 25 Кб, 1286x715
25 Кб, 1286x715Пикрелейтед: Колбы для перегонки жидкостей: Клайзена (а), Арбузова (б, в) и Стоута и Шуэтта (г).
Похоже на третью колбу Арбузова для перегонки.
Ебаный абу сын шалавы не хочет чинить постинг картинок.
>Tentative cause is thermocouple for hotplate didn't make it into oil bath overheating the glass bomb. Explosion followed by contained fire that was out before we got in this morning.
Маслянная баня бабахнула.
Хуево. Но ничего, нанять уборщиков, может заменить тягу.
скатол
Кофеин.
 90 Кб, 535x485
90 Кб, 535x485У меня есть вопросы.
Правда ли, что плёнка оксида алюминия способна удержать даже атомы гелия и что, мол, именно алюминием покрывали дирижабли?
Какого размера сота в ячейке фуллерена? Мне интересно до какого атома по размеру включительно эти решётки могут через себя пропускать, а какие - не пролезут?
Существуют ли квазикриссталлические молекулярные структуры? То есть, связь идёт не валентно-ковалентная и не ионная, а какая-то другая. Например, H2SO4 "держит при себе" 12 если не ошибаюсь молекул воды. Почему так? Ведь и вода и кислота уже не ионы, а нормальные нейтральный молекулы. Есть ли аналогичное среди металлов, инертных газов? А могут ли быть такие квазикриссталлические структуры твёрдыми или хотя бы плотножидкостными?
 435 Кб, 720x384
435 Кб, 720x384Чего блять?
Кинетика.
1- алюминий легок, поэтому из него делали и дирижабли и самолеты. гелий может и резиновый шарик удержать.
2- фуллерен не пропускает ни в себя не из себя никакие атомы или молекулы. вообще.
3- "квазикриссталлические молекулярные структуры" предсказаны, но не открыты. Межмолекулярных взаимодействий много, например, водородная связь или дипольные взаимодействия. Серная кислота в воде нацело диссоциирована.
Почему? Газовые гидраты вполне себе подходят под описание.
Это не то. Там же в итоге затухание реакции. А я-то говорю про полностью цикличные. Например есть не помню что за вещество, вроде с кобальтом или марганцем, который меняет цвета с синего на розовый в зависимости от толи теплоты, толи света. Вот так всё полностью циклично, а тут - не очень
Правда, штоле? Я хочу посмотреть на людей, которые это сделали.
Годнота это нерд рейдж или найл ред, а это хуита и конвеер. Прочитать статью из вики на 8 минут, сделать не сложный опыт и это все, пиздец какая годнота, я аж обосрался. Как развлекательный контент для быдла покатит, для человека хоть как-то увлекающегося химией хуита.
младой человек, интересна биохимия (химия жизни на молекулярном уровне, если не ошибаюсь) (где искать литературу (но что б понятным языком более-менее) посоветуй, что читать), спасибо заранее :3
В основном гугл. Но вот что нашёл: сайт - http://biokhimija.ru/
Список литературы: http://diplomart.ru/subjects/lit-0055.html
http://biokhimija.ru/klinicheskajabiohimija/49-litrache/356-spisok.html
А ещё, вот тут посмотри:
http://gen.lib.rus.ec/search.php?req=Биохимия
http://gen.lib.rus.ec/search.php?req=Biochemical
>>14821
http://gen.lib.rus.ec/search.php?req=Ленинджер
Вот она - в трёх томах.
Как качать - разберёшься самостоятельно.
Генезис.
>Как минимум - запачкает глутамат натрия, как максимум ещё и прореагировать может.
Что ты несёшь?
 49 Кб, 600x604
49 Кб, 600x604> 2- фуллерен не пропускает ни в себя не из себя никакие атомы или молекулы. вообще.
Ага, как же. Let's me show you wikipedia.
https://ru.wikipedia.org/wiki/Фуллерен
> Однако не все связи С-С имеют одинаковую длину. Связь С=С, являющаяся общей стороной для двух шестиугольников, составляет 1,39 Å, а связь С-С, общая для шести- и пятиугольника, длиннее и равна 1,44 Å[16].
https://ru.wikipedia.org/wiki/Ангстрем
> старевшая внесистемная единица измерения длины, равная 10−10 м (1 Å = 0,1 нм = 100 пм; 10 000 Å = 1 мкм). Названа в честь шведского физика и астронома Андерса Ангстрема, предложившего её в 1868 году[1]. Ранее данная единица измерения часто использовалась в физике, поскольку 10−10 м — это приблизительный диаметр орбиты электрона в невозбуждённом атоме водорода.
Водород может спокойно входить и выходить в решёт фуллерена, как ножи в тело Цезаря
>и выходить в решёт фуллерена
нет не может. атомы не материальные точки, знаешь ли. между ними какбы электроны.
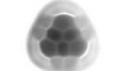 70 Кб, 699x393
70 Кб, 699x393Так просто не загонишь, какой-нибудь атом гелия, еще меньше. но он не может вылететь так просто из фуллерена. Молекула это в первую очередь электронное облако, в котором находятся ядра. Именно такое определение.
Электронная плотность распределяется очень забавно, и так просто затолкать атом нельзя. Но это делают раскрывая фуллерен химически, а потом обратно закрывают. Гугли инкапсулированные соединения. Обозначаются с помощью знака собаки. Например
La@C60
Я нашел для тебя даже статейку
http://pubs.rsc.org/en/Content/ArticleLanding/2009/JM/b904234b#!divAbstract
>>14894
>>14895 - кун
потенциальный барьер прохода маленького атома через центр шестичленника сравним по энергии с энергией разрыва связи.
Я как-то дома хотел посчитать C60 на компе DFTшкой, он пару дней мне матерился. Эх... мне бы кластер.
Orca
 410 Кб, 1024x512
410 Кб, 1024x512в неё влезет атом железа?
а золота?
а урана?
а мейтнирия?
а не разрушится ли фуллерен в угоду построению химической связи с запертым внутри атомом?
 98 Кб, 1080x810
98 Кб, 1080x810Оче похожая на гемоглобин молекула холорофила почти одно и то же с гемоглобином, только вместо железа в ней магний, который присущ уже растениям и делает их кровь сок зелёным.
А что насчёт ГРИБОВ? Они же ни рыба, ни мясо, ни к селу, ни к городу. Что у них? Небось, какой-нибудь ещё метал, чтоб не железо и не магний. Алюминий например.
https://www.google.com/search?q=радиус+углерода
https://www.google.com/search?q=радиус+атома+железа
https://www.google.com/search?q=радиус+золота
https://www.google.com/search?q=радиус+элемента+урана
https://www.google.com/search?q=радиус+мейтнирия
Расстояние между ближайшими атомами углерода в шестиугольниках,
обозначенное a0, составляет 0,142 нм.
Это - у графена, это паста с википедии, и она гуглится.
Очень большая, туда и молекулы запихивают. Фуллерен не разрушается, бывает два варианта, либо атом сидит в центре как сыч. Либо атом цепляется к стенке изнутри.
 2,9 Мб, 320x205
2,9 Мб, 320x205Я имел в виду внутренний объём решётки фуллерена в целом, а не радиус отдельно взятой ячеечной соты С-С на это фуллерене.
Может мне интересно, сколько всего можно напихать внутрь. и может внутри фуллерена ещё какая-нибудь кристаллическая решётка, внутри которой тоже что-нибудь будет.
Ну так вот берёшь backyball c-60 и считаешь исходя из размера одной связи C-C.
Разрешающая способность лучших электронных микроскопов около 0.6нм, а рассчитанный наружный диаметр фуллерена C60 – 0.71нм. Поэтому определить по тем размытым теням, что на электронных изображениях, где границы молекулы невозможно.
Однако, Согласно официальной парадигме квантовой химии, фуллерен C60 содержит 60 атомов углерода. Его наружный диаметр равен 0.7нм, внутренний – 0.44нм.
Алсо, наружный диаметр нанотрубки C60 также равен 0.7нм, внутренний – 0.44нм. Поперечный размер атомов кобальта и никеля равен 0.38нм.
Всё это гуглится.
То есть, иными словами, это решето поганое, ибо у него ширина решётки в нанометрах, измеряются в пикометрах.
А это значит, что кристаллическая решётка фуллерена настолько разработана, что в неё спокойно влезет атом сгущёнки
госпади... ты реально представляешь атомы в виде палочек и точечек? Какое нахуй решето?
Ну смотри, 1 нанометр - это 1000 пикометров.
Если наружный диаметр равен 0.7нм, о каких нанометрах может идти речь,
если даже 1 нанометра нет. Тут очевидные 700 пикометров и шкала в пикометрах, значит.
Это же касается и диаметра внутреннего, там получается 440 пикометров.
Если взять тот же мейтнирий с его 200-ми пикометрами - он влез бы туда охлаждённым,
но колебаясь там внутри от тепла, этот атом, наверное, мог бы и разрушить этот бакибол.
Хотя вот ядро атома маленькое и могло бы колебаться долго ещё там, если конечно электроны
вылезут на поверхность фуллерена. Но если вслед за ядром прут и электроны,
то при сильных колебаниях ядра, вполне возможнен разрыв этих всяких ван-дер-ваальсовских связей.
Что ты имел ввиду под "вылезти", упоминая электронную плосность? При этом надо понимать, что электронная плотность, обволакивает весь фуллерен, и минимум её приходится на его центр. Еще возможен сценарий, когда металл отдаст электроны на фуллерен, а сам станет с плюсовым зарядом, тогда эти лишние электроны распределятся по всему фуллерену, а атом металла сожмется.
https://butlerov.com/files/reports/2015/vol41/2/130/130-134.pdf
Вот совсем простенькая статья с расчетами.
>Что ты имел ввиду под "вылезти", упоминая электронную плосность?
Я имел в виду, что атомы имеет кинетическую энергию, если вещество не охлаждено до нуля кельвинов.
При этом, колебается не ядро, а сам атом, т. е. электроны.
Если электроны вылазят на поверхность фуллёрена, они расталкивают другие электроны.
Если дофига электронов вылезет на поверхность, они могут растолкнуть и атомы углерода, разорвав между ними связь.
>отдаст электроны на фуллерен
Ну если большой атом (а ты глядишь в мейтнирий), то все электроны он не отдаст.
Потому что вот здесь, йод, имея заряд ядра 52, а значит 52 электрона - при ионизации отдал
лишь 47 электронов а потом, при притяжении этих электронов -
вообще схлопнулся от возникшего эффекта Оже - в чёрную дыру:
https://lenta.ru/articles/2017/06/01/hole/
У тебя что-то странное в голове происходит. И некоторые электроны будут отталкиваться а некоторые будут притягиваться, ибо есть различные орбитали. Плюс электроны не колеблятся. Колеблется ядро атома, а электронная плотность очень, очень быстро под это колебание подстраивается, если бы так не было, приближение Борна-Оппенгеймера не работало бы для описания молекул. Плюс чтобы атом разломал фуллерен, его энергия колебания должна быть очень большой, такие энергии он будет принимать лишь при температурах в тысячи градусов. Так то. И кинетическая энергия будет у атома, даже если температура 0К.
 524 Кб, 700x525
524 Кб, 700x525Я сейчас вспомнил школу, и таких два что ли.
>И некоторые электроны будут отталкиваться а некоторые будут притягиваться, ибо есть различные орбитали.
Ну притягиваются они исключительно из-за наличия спина, который при этом зануляется,
или же, скорее всего из-за магнитного момента который формирует этот спин,
поэтому такие электроны являются спаренными, и укладываются по два на орбиталь,
образуя волновую функцию этой орбитали, либо по одному, если неспаренный. Там правило Хунда.
Но, ИМХО, кулоновское отталкивание между ними намного больше, нежели магнитное-спиновое притяжение.
 193 Кб, 433x489
193 Кб, 433x489Они "притягиваются" не из-за магнитного момента, ибо выгодно спины в одну сторону направить(а если они спариваются, то они в разную). А из-за обменного взаимодействия, которое имеет чисто кулоновскую природу, но возникает из-за наложенных симметрий на волновую функцию. Еще можно описать это как взаимодействие "дырки" на орбитали и электрона, последние очевидно будут притягиваться. В любом случае надо смотреть на конкретный атом в фулерене. Если это инертный газ, то он взаимодействует с фуллереном, чисто межмолекулярными взаимодействиями, орбитали не перекрываются, а электроны пытаются отталкиваться. Если это какой-нибудь активный элемент, то он перекроет свои орбитали с орбиталями фуллерена, и будет ковалентная связь с атомами углерода, он прицепится на каркас. Если это будет активный металл, типа натрия, или лантана, то его орбитали сильно выше пустых орбиталей фуллерена, и ему невыгодно будет перекрываться с ними, но выгодно будет просто сбросить туда свои электроны, с более высокой, на более низкую. Тогда весь фуллерен получит минусовой заряд, а атом будет заряжен положительно. Если кстати не засовывать атом внутрь, то получится обычный фуллерид, соль с анионом фуллерена.
У С60 довольно низкая LUMO, он очень любит электрончики.
>Они "притягиваются" не из-за магнитного момента
Ну есть же аномальный магнитный момент у электрона.
>ибо выгодно спины в одну сторону направить(а если они спариваются, то они в разную).
Почему это электронам выгодно спины в одну сторону направить? Принцип Паули держи.
Кстати, что касается спина и аномального магнитного момента - я представляю себе это так...
Спин (от англ. spin, буквально — вращение, вращать(-ся)) — собственный момент импульса элементарных частиц, имеющий квантовую природу и не связанный с перемещением частицы как целого.
Короче что-то там внутри электрона крутится. А у электрона - заряд.
А если крутится заряд, то создаётся что-то типа кольцевого тока по периметру электрона, как в катушке,
а значит и направленное магнитное поле как у электромагнита.
Но электрон - частица элементарная, у него нет периметра, к тому же она как-бы размыта в пространстве,
потому что масса маленькая по сравнению с нуклонами, а заряд тот же,
и принцип неопределённости Гейзенберга на ядро и электрон распространяется.
Поэтому существуют электронные облака, как-бы указывающие на вероятность
положения электрона в том или ином месте там.
Но спин - электрона это не вращение его вокруг какой-то там оси, в прямом смысле.
Там алгебры Клиффорда, спинорные группы, спинор.
К тому же у электрона спин не равен 1, и вращением назвать это нельзя, потому что вращение - поворот на 360 градусов.
У электрона - полуцелый спин, 1/2, и это соответствует 720 градусам. Пример - четырехтактный двигатель, или же анимация на пике2.
Короче, в любом случае там что-то вращается, а раз вращается, и если есть заряд, значти и магнитное поле есть,
и если вращается в фазе - то магнитное поле одинаковое генерируется, а если вращается в противофазе, то разные.
А дальше, короче, магнитики держи, только представь, что они ещё и крутятся,
ну или появляются или исчезают из-за этих спинов, например...
>Если кстати не засовывать атом внутрь, то получится обычный фуллерид, соль с анионом фуллерена.
Интересно, как интерферируют соли фуллёренов?
>Они "притягиваются" не из-за магнитного момента
Ну есть же аномальный магнитный момент у электрона.
>ибо выгодно спины в одну сторону направить(а если они спариваются, то они в разную).
Почему это электронам выгодно спины в одну сторону направить? Принцип Паули держи.
Кстати, что касается спина и аномального магнитного момента - я представляю себе это так...
Спин (от англ. spin, буквально — вращение, вращать(-ся)) — собственный момент импульса элементарных частиц, имеющий квантовую природу и не связанный с перемещением частицы как целого.
Короче что-то там внутри электрона крутится. А у электрона - заряд.
А если крутится заряд, то создаётся что-то типа кольцевого тока по периметру электрона, как в катушке,
а значит и направленное магнитное поле как у электромагнита.
Но электрон - частица элементарная, у него нет периметра, к тому же она как-бы размыта в пространстве,
потому что масса маленькая по сравнению с нуклонами, а заряд тот же,
и принцип неопределённости Гейзенберга на ядро и электрон распространяется.
Поэтому существуют электронные облака, как-бы указывающие на вероятность
положения электрона в том или ином месте там.
Но спин - электрона это не вращение его вокруг какой-то там оси, в прямом смысле.
Там алгебры Клиффорда, спинорные группы, спинор.
К тому же у электрона спин не равен 1, и вращением назвать это нельзя, потому что вращение - поворот на 360 градусов.
У электрона - полуцелый спин, 1/2, и это соответствует 720 градусам. Пример - четырехтактный двигатель, или же анимация на пике2.
Короче, в любом случае там что-то вращается, а раз вращается, и если есть заряд, значти и магнитное поле есть,
и если вращается в фазе - то магнитное поле одинаковое генерируется, а если вращается в противофазе, то разные.
А дальше, короче, магнитики держи, только представь, что они ещё и крутятся,
ну или появляются или исчезают из-за этих спинов, например...
>Если кстати не засовывать атом внутрь, то получится обычный фуллерид, соль с анионом фуллерена.
Интересно, как интерферируют соли фуллёренов?
>Почему это электронам выгодно спины в одну сторону направить? Принцип Паули держи.
как раз, если бы не принцип Паули, то они хотели бы направить в одну сторону(как это и происходит, принцип Хунда). Банальное взаимодействие двух магнитных диполей, они так взаимодействуют, чтобы усилить общее поле. Но когда мы накладываем ограничение в виде принципа Паули, и плюс в том виде что электроны неразличимы, то выпрыгивает интересный интеграл, который включает в себя обычные кулоновские взаимодействия, но со знаком зависящим от ориентации спинов!!(кулоновское, которое фактически притягивает электроны sic!).
>Банальное взаимодействие двух магнитных диполей, они так взаимодействуют, чтобы усилить общее поле.
Ну вот если два магнита соединяются вместе примерно таким вот образом (пик1),
общий, существенный магнитный поток из их полюсов - зануляется, а поле становится замкнутым:
юг одного магнита - в север другого, и юг второго - на север первого.
Получается очень слабый магнитный поток лишь по краям этой спаренной сборки (Пик2),
а выходящие из севера концентрированным пучком стрелочки - уходят на юг второго магнита сразу,
как и нижние. Ну а если они вращаются допустим, вращаться они будут тоже синхронно,
находясь вместе при этом, как шестерёнки. Поэтому я и написал, что магнитный момент связан со спином.
А как эти магнитные моменты там меняется в зависимости от спина - непонятно.
А ещё, есть магнитная сборка Халбаха, где магнитные поля, перекрываясь и отводясь,
приводят к тому, что внизу магнитное поле сборки - почти отсутствует. Пикрелейтед.
https://ru.wikipedia.org/wiki/Магнитная_сборка_Халбаха
Наоборот, смотри на магнитные линии внутри магнита. Магнитный диполь ориентируется ПО магнитному полю. У тебя ничего не занулилось, а магнит только сильнее стал или ты троллишь
 23 Кб, 294x315
23 Кб, 294x315Ну видишь силовые линии магнитного поля идут как-бы из севера - в юг,
на второй пикче здесь >>14995, и огибают весь магнит,
и расходясь из полюсов всё-равно как-бы, по большему радиусу
заходят в югиз севера.
К чему этим силовым линиям быть такими, если из севера одного магнита
- они могут зайти в юг другого магнита? Нутыпонял. Пикрил.
Конечно могут быть какие-то силовые линии от севера к югу по бокам сборки,
как и на пикче 2 поста >>14995, но суммарная их напряжённость несущественна, основные силовые линии замыкаются как и на пикче 2 поста >>14996
Гугли реакции спонтанного деления элементов, которые тебя интересуют, и возможно - увидишь что они излучают.
Если речь идёт о уране-235, то спонтанное деление идёт с размножением нейтронов.
Иначе, в покое, уран-235 претерпевает α-распад в торий-231 c периодом полураспада 61(4) ms.
Электронами как ты собрался бомбардировать ядра? Они слишком большие по размеру, по сравнению с нуклонами,
и скорее свяжутся в электронные оболочки, нежели проникнут внутрь ядра.
При облучении протонами, протонам нужно преодолеть кулоновский барьер.
А нейтроны захватываются ядрами без необходимости преодолевать кулоновский барьер,
и тем активнее, чем меньше энергия, а значит импульс и скорость нейтронов.
Иначе высокоэнергичные нейтроны могут неупруго рассеиваться на ядрах, и даже упруго.
>Вот есть ядро урана 235, в нем 92 протона и 143 нейтрона если нейтрон делит ядро то может по идее получится любой элемент?
Этот уже ответил. >>15066
При составлении структурной формулы по брутто формуле или ЯМР-спектру помогало.
Ненасыщенность. Вопрос кстати скорее в тред "тупых вопросов". Максимально насыщенное соединение СnOmNkH(2n+k+2) Если водородов меньше, значит есть двойные связи или циклы. Каждая двойная связь уменьшает количество водородов на 2, цикл тоже.
 18 Кб, 873x718
18 Кб, 873x718Трет-амиловый спирт используют в рекреационных целях и вполне успешно.
Почему не используют трет-бутиловый спирт? По крайней мере я не нашёл вообще никакой информации в интернете об этом.
>трет-бутиловый спирт
Попробуй погуглить его метиловый и этиловый эфиры с точки зрения рекреации. Если они не токсичны, конечно.
не гуглится
Лучше ацетат натрия с едким натром прокалить:
CH3COONa + NaOH = CН4↑ + Nа2СО3
А потом оксид натрия получить, прокаливанием карбоната натрия при 1000 °C,
получаемого в свою очередь прокаливанием гидрокарбоната натрия при 270 °C:
2NaHCO3 -> Na2CO3 + H2O + CO2;
Na2CO3 -> Na2O + CO2;
Из оксида или карбоната - вернуть гидроксид натрия:
Na2O + H2O -> 2NaOH;
Na2CO3 + H2O -> NaHCO3 + NaOH;
И залить его неполностью - уксусной кислотой для возврата ацетата с гидроксидом натрия,
которая содержалась в изначальной прокаливаемой смеси:
CH3COOH + NaOH = CH3COONa + H2O;
Можно и так, чтоб меньше воды выделялось:
2CH3COOH + Na2O = 2CH3COONa + H2O;
Так: Na2CO3 + 2 CH3COOH = 2CH3COONa+ H2О + CO2;
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑;
А потом смешать ацетат с едким натром и снова прокалить. На выходе - метан.
Суммарная реакция всего этого - разложение уксусной кислоты в метан:
CH3COOH = CН4↑ + CO2;
А уксусную кислоту получить - карбонилированием метанола: CH3OH + CO=CH3COOH
Процесс проводится при 170—200° и 3 МПа с гомогенным катализатором на основе родия и йода.
Метанол же - получается синтезом из синтез-газа, который можно получить из ацетилена.
Также, прямо из ацетилена, реакцией Кучерова и по процессу Вакера можно получить ацетальдегид,
окисляя который - можно получить уксусную кислоту - в обход метанола:
https://ru.wikipedia.org/wiki/Уксусная_кислота#.D0.93.D0.B8.D0.B4.D1.80.D0.B0.D1.82.D0.B0.D1.86.D0.B8.D1.8F_.D0.B0.D1.86.D0.B5.D1.82.D0.B8.D0.BB.D0.B5.D0.BD.D0.B0_.D0.B2_.D0.BF.D1.80.D0.B8.D1.81.D1.83.D1.82.D1.81.D1.82.D0.B2.D0.B8.D0.B8_.D1.80.D1.82.D1.83.D1.82.D0.B8_.D0.B8_.D0.B4.D0.B2.D1.83.D1.85.D0.B2.D0.B0.D0.BB.D0.B5.D0.BD.D1.82.D0.BD.D1.8B.D1.85_.D1.81.D0.BE.D0.BB.D0.B5.D0.B9_.D1.80.D1.82.D1.83.D1.82.D0.B8
Процесс разложения ацетата натрия с выделением метана - ты можешь наблюдать, например здесь:
https://www.youtube.com/watch?v=S5hlE1OC-ko
Лучше ацетат натрия с едким натром прокалить:
CH3COONa + NaOH = CН4↑ + Nа2СО3
А потом оксид натрия получить, прокаливанием карбоната натрия при 1000 °C,
получаемого в свою очередь прокаливанием гидрокарбоната натрия при 270 °C:
2NaHCO3 -> Na2CO3 + H2O + CO2;
Na2CO3 -> Na2O + CO2;
Из оксида или карбоната - вернуть гидроксид натрия:
Na2O + H2O -> 2NaOH;
Na2CO3 + H2O -> NaHCO3 + NaOH;
И залить его неполностью - уксусной кислотой для возврата ацетата с гидроксидом натрия,
которая содержалась в изначальной прокаливаемой смеси:
CH3COOH + NaOH = CH3COONa + H2O;
Можно и так, чтоб меньше воды выделялось:
2CH3COOH + Na2O = 2CH3COONa + H2O;
Так: Na2CO3 + 2 CH3COOH = 2CH3COONa+ H2О + CO2;
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑;
А потом смешать ацетат с едким натром и снова прокалить. На выходе - метан.
Суммарная реакция всего этого - разложение уксусной кислоты в метан:
CH3COOH = CН4↑ + CO2;
А уксусную кислоту получить - карбонилированием метанола: CH3OH + CO=CH3COOH
Процесс проводится при 170—200° и 3 МПа с гомогенным катализатором на основе родия и йода.
Метанол же - получается синтезом из синтез-газа, который можно получить из ацетилена.
Также, прямо из ацетилена, реакцией Кучерова и по процессу Вакера можно получить ацетальдегид,
окисляя который - можно получить уксусную кислоту - в обход метанола:
https://ru.wikipedia.org/wiki/Уксусная_кислота#.D0.93.D0.B8.D0.B4.D1.80.D0.B0.D1.82.D0.B0.D1.86.D0.B8.D1.8F_.D0.B0.D1.86.D0.B5.D1.82.D0.B8.D0.BB.D0.B5.D0.BD.D0.B0_.D0.B2_.D0.BF.D1.80.D0.B8.D1.81.D1.83.D1.82.D1.81.D1.82.D0.B2.D0.B8.D0.B8_.D1.80.D1.82.D1.83.D1.82.D0.B8_.D0.B8_.D0.B4.D0.B2.D1.83.D1.85.D0.B2.D0.B0.D0.BB.D0.B5.D0.BD.D1.82.D0.BD.D1.8B.D1.85_.D1.81.D0.BE.D0.BB.D0.B5.D0.B9_.D1.80.D1.82.D1.83.D1.82.D0.B8
Процесс разложения ацетата натрия с выделением метана - ты можешь наблюдать, например здесь:
https://www.youtube.com/watch?v=S5hlE1OC-ko
Ну там температура в 1400 градусов, боюсь даже этану плохенько будет.
 55 Кб, 640x425
55 Кб, 640x425реакция белоусова-жаботинского
https://practicum.melscience.com/experiments/belousov-zhabotinsky-reaction.html
реакция галиевого сердца
https://www.youtube.com/watch?v=BuZOemSiKI0&ytbChannel=Thoisoi
4Al+3C -> Al4C3;
(1800 °C) 2Al2O3 + 9C -> Al4C3+6CO;
Al4C3+12H2O -> 4Al(OH)3↓ + 3CH4↑;
6H2SO4 + Al4C3 -> 2Al2(SO4)3 + 3CH4↑;
Al4C3+4NaOH+12H2O -> 4Na[Al(OH)4]+3CH4↑;
>CO
CO+2H2 -> CH3OH;
CH3OH + CO=CH3COOH;
В лаборатории метан получают нагреванием натронной извести (смесь гидроксидов натрия и кальция)
или безводного гидроксида натрия с ледяной уксусной кислотой:
2NaOH+CH3COOH ->Na2CO3+H2O+CH4↑;
Карбонат - прокалить до оксида, и водой потом залить.
>оксциклотаумерия
Нет такого слова. Есть цикло-оксо-таутомерия:
http://uclg.ru/education/himiya/10_klass/uglevodyi/lecture_lec_tsiklo-okso-tautomeriya_monosaharidov.html
Нахрена три оксигена, в серотонине лишь один атом кислорода
и то гидроксильную группу составляет, пик1.
И ещё пару пикчей принёс.
Акролеин тоже неплохо.
Есть ещё похлеще - денатония сахаринат и тиоацетон.
>синтез тестостерона из холестерина
Просто оставлю это здесь. Кстати, как можно видеть, эстриол тоже из тестостерона получается, причём необратимо и через эстрадиол.
Ну углеводороды в воде не растворяются, и зёрна глутамата в петролейном эфире - тоже вымыть сложно будет, если вообще с этими углеводородами петролейного эфира не пойдёт реакция глутамата. У него же кислород там есть.
>У него же кислород там есть.
Ты хотя бы отдаешь себе отчёт в том, что алканы не будут реагировать с чем попало? Ни с аминами, ни с карбоновыми кислотами, ни с карбоксилатами они реагировать не будут.
>Оче похожая на гемоглобин молекула холорофила почти одно и то же с гемоглобином
Нет. Похожиц на хлорофилл гем - один из компонентов гемоглобина. Вот статья о порфиринах:
https://ru.wikipedia.org/wiki/Порфирины
 45 Кб, 498x441
45 Кб, 498x441Полимеров.
![65806048[1].jpg](/sci/big/thumb/414180/14987761417320s.jpg) 33 Кб, 1403x236
33 Кб, 1403x236Существуют ли такие же яркие химические реакции с водой,
AgNO3 + Mg -> MgO + Ag + NO2
но с более доступными компонентами, нежели вот этот вот нитрат серебра:
https://www.youtube.com/watch?v=3GfPj3vSJEs
Я так полагаю, чтобы ответить на этот вопрос - надо смотреть в электроотрицательность химических элементов.
Пикрелейтед. Ближайшее из устойчивых соединений, что я могу предположить - это магний с нитратом меди или никеля.
Будут ли они так же бурно реагировать, если в смесь воды капнуть?
Дохуя, прямо в смысле ДОХУЯ
Думаю вкатиться куда-нить, по идее не плохо химия ага
в мире химический концерн, и там бабло и походу химики нужны.
 1023 Кб, 790x790
1023 Кб, 790x790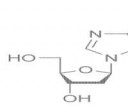 15 Кб, 572x480
15 Кб, 572x480Дезоксигуанозин
>ГМТД
Судя по структурной формуле - да, так как у него много кислорода там. Если конечно он разлагается на кислород без доступа воздуха.
И если температуры вспышки и газов после сгорания хватит, чтобы поддерживать реакцию горения.
Если реакция будет идти медленно - детонации метана не будет.
Он может просто выгореть медленно.
Можешь сделать так:
1. Взять пищевую соду и часть её смешать с уксусом - чтобы получить ацетат натрия.
2. Вторую часть соды - прокалить в оксид натрия:
2NaHCO3 —(200 °C)—>Na2CO3+CO2+H2O —(1000 °C)—> Na2O+2CO2+H2O
3. Залить образовавшийся оксид натрия стехиометрическим количеством воды, чтобы получить NaOH.
4. Прокалить смесь ацетата натрия с едким натром - получая метан.
5. Метан собрать в герметичную ёмкость, запхнуть туда этот свой ГМТД,
и долбануть по нему, как по капсюлю какому-нибудь или пистону - без доступа воздуха.
Только учти, что если метан без доступа воздуха, если и будет гореть - он будет гореть только за счёт кислорода, который выделяется.
А вот насчёт детонации - это скорее зависит от количества ГМТД, если вообще горение будет идти,
и если он, разлагаясь - выделяет свободный молекулярный или атомарный кислород.
Смотря в каких пропорциях. Если ты пукнешь чуток туда - врядли сдетонирует.
Метан взрывоопасен при концентрации в воздухе от 4,4 % до 17 %.
Наиболее взрывоопасная концентрация 9,5 %
Если скорости горения и энергии хватит, то вполне возможно, хотя у твоего этого гмтд она больше 4000
У меня тут вопрос про концентрации. Допустим есть вещество А, со смертью от передозировки в 100г. Будет ли разница если человек сожрет сразу же 100 г.(100% концентрация) или растворит в 100 г. воды(50% концентрации) и выпьет залпом, с одной стороны разные концентрации, но масса та одна и та же. Или например серной кислоты чтобы окислить платинку нужно 250 г. Будет ли разница если платину засунуть в 250 г. 100% серной кислоты (да-да знаю максимум серной кислоты 98%, но мы тут мысленный эксперимент проводим) или 500 г. 50% раствор(по массе) серной кислоты, и там и там масса, т.е. количество молекул серной кислоты одна и та же, но разная концентрация.
Платина медленно растворяется в горячей концентрированной серной кислоте.
Если твоё токсичное вещество A слаборастворимо в воде, понятно,
что сожрав его ты его тупо высрешь и всё.
А вот если хорошо растворимое производное - тогда пизда.
Например, клетчатка. Проводишь кислотный гидролиз клетчатки, получаешь глюкозу,
и сироп в крови, и пиздец блядь и диабет и смерть мерзкая от наркотиков,
и от того что жопа слипнеться и всё будет в шоколаде.
В школьной неорганике, бери таблицу растворимости и смотри где образуется осадок вода или газ
тиопентал-натрий и натрия оксибутират, по идее, после вывода из наркоза, должны давать галлюцинации
В первом ещё азот нужен, а у второй - сложная штука, саму вряд ли удастся сделать.
*самому
2.Можно снизить вероятность лопанья яйца если подсолить воду? Водно солевой баланс там хуе-мое, вода из яиц потянется к соли, осмотическое давление ослабнет и будет збс. Или я на ебался?
 135 Кб, webm,
135 Кб, webm,614x480
Засунь свою промежность в свч, будет заебись.
ну не обязательно закись использовать для ввода в наркоз. поддержание - да, определенно необходим. а если ввести-вывести, чтобы получить галлюцинации, то не нужен. или ты про получение?
Смотрите что нашёл: http://sportwiki.to/Список_аминокислот
А давайте-ка, у кого есть время - распишем здесь полный синтез аминокислот,
и синтез малодоступных реагентов необходимых для их синтеза - из доступных?
Чтобы все охуели.
Начну я. Итак, по порядку:
Валин.
Рацемический валин может быть синтезирован путем бромирования изовалериановой кислоты
с последующим аминированием аммиаком - альфа-бром-производного:
HO2CCH2CH(CH3)2 + Br2 → HO2CCHBrCH(CH3)2 + HBr
HO2CCHBrCH(CH3)2 + 2NH3 → HO2CCH(NH2)СН(СН3)2 + NH4Br
Химический синтез изовалериановой кислоты - возможен:
окислением изоамилового спирта (перманганатом калия, дихроматом калия с серной кислотой,
воздухом в присутствии катализаторов, электрохимическим методом и др.);
из малонового эфира; из бромистого изобутила с использованием металлического магния.
Бромистый изобутил получается бромированием изобутана. Изобутан - изомеризацией бутана.
Бутан - реакцией Вьюрца из бром-этана. Бром-этан - бромированием этана.
Этан - широко распространён и доступен.
Изолейцин. Изолейцин может быть синтезирован в ходе многоступенчатой процедуры,
начиная с 2-бромбутана и диэтилмалоната. В 1905 году впервые был создан синтетический изолейцин.
В 1903 году немецкий химик Феликс Эрлих обнаружил изолейцин в гемоглобине.
И больше ничего найти не удалось.
Лейцин. Синтез лейцина на основе малонового эфира. Пикрелейтед.
http://studopedia.ru/2_97365_sposobi-polucheniya-aminokislot.html
В качестве исходного вещества для получения малонового эфира
берут монохлоруксусную кислоту, которую переводят в калиевую соль
и действуют на нее цианистым калием.
Смотрите что нашёл: http://sportwiki.to/Список_аминокислот
А давайте-ка, у кого есть время - распишем здесь полный синтез аминокислот,
и синтез малодоступных реагентов необходимых для их синтеза - из доступных?
Чтобы все охуели.
Начну я. Итак, по порядку:
Валин.
Рацемический валин может быть синтезирован путем бромирования изовалериановой кислоты
с последующим аминированием аммиаком - альфа-бром-производного:
HO2CCH2CH(CH3)2 + Br2 → HO2CCHBrCH(CH3)2 + HBr
HO2CCHBrCH(CH3)2 + 2NH3 → HO2CCH(NH2)СН(СН3)2 + NH4Br
Химический синтез изовалериановой кислоты - возможен:
окислением изоамилового спирта (перманганатом калия, дихроматом калия с серной кислотой,
воздухом в присутствии катализаторов, электрохимическим методом и др.);
из малонового эфира; из бромистого изобутила с использованием металлического магния.
Бромистый изобутил получается бромированием изобутана. Изобутан - изомеризацией бутана.
Бутан - реакцией Вьюрца из бром-этана. Бром-этан - бромированием этана.
Этан - широко распространён и доступен.
Изолейцин. Изолейцин может быть синтезирован в ходе многоступенчатой процедуры,
начиная с 2-бромбутана и диэтилмалоната. В 1905 году впервые был создан синтетический изолейцин.
В 1903 году немецкий химик Феликс Эрлих обнаружил изолейцин в гемоглобине.
И больше ничего найти не удалось.
Лейцин. Синтез лейцина на основе малонового эфира. Пикрелейтед.
http://studopedia.ru/2_97365_sposobi-polucheniya-aminokislot.html
В качестве исходного вещества для получения малонового эфира
берут монохлоруксусную кислоту, которую переводят в калиевую соль
и действуют на нее цианистым калием.
>А давайте-ка, у кого есть время - распишем здесь полный синтез аминокислот,
Давай-ка ты пойдешь в интернет и нагуглишь подходящую книгу, наверняка же есть.
А давай-ка ты подскажешь мне её.
Продолжаю...
>>16826
Метионин.
Промышленный синтез DL-метионина осуществляют исходя из акролеина.
На первой стадии присоединением метилмеркаптана к акролеину синтезируют 3-метилтиопропионовый альдегид:
CH3SH + H2C=CH-CHO → CH3SCH2CH2CHO
который далее используется в качестве карбонильного компонента синтеза Штреккера:
CH3SCH2CH2CHO + HCN + NH3 → CH3SCH2CH2CH(NH2)CN
CH3SCH2CH2CH(NH2)CN + H2O → CH3SCH2CH2CH(NH2)COOH
В лаборатории акролеин получается дегидратацией глицерина в присутствии гидросульфата калия.
В промышленности акролеин получают каталитическим окислением пропилена над оксидными висмут-молибденовыми катализаторами или оксидом меди.
Ранее в промышленности был распространён процесс парофазной кротоновой конденсации ацетальдегида с формальдегидом (устаревший метод):
CH2O + CH3CHO → CH2=CH−CHO + H2O
Треонин.
Синтез треонина осуществляют восстановлением 2-нитрозоацетоуксусного эфира или фенилазоацетоуксусного эфира,
альдольной конденсацией ацетальдегида с медной солью глицина, а также из кротоновой кислоты.
Реакций не нашёл, но более привлекательной реакцией, ИМХО, является выделенная, так как более доступные реагенты там.
Триптофан.
Для получения триптофана, индол аминометилируют формальдегидом и диметиламином по методу Манниха.
Полученный 3-диметиламинометилиндол конденсируют с метиловым эфиром нитроуксусной кислоты,
что приводит к метилату 3-индолилнитропропионовой кислоты. Затем восстанавливают нитрогруппу до аминогруппы.
После щелочного гидролиза эфира получают D,L-триптофан обычно в форме натриевой соли.
В триптофане, полученном химическим синтезом, обнаруживаются примеси токсичных соединений.
Синтетический триптофан добавляют в комбикорма для животных.
Обычно индол выделяют из нафталиновой фракции каменноугольной смолы или получают
дегидрированием о-этиланилина с последующей циклизацией образующегося продукта. Пикрелейтед.
Фенилаланин.
Фенилаланин в промышленных масштабах получают микробиологическим способом. Там какая-то ферментативная реакция.
Возможен также химический синтез - это синтез Эрленмейера из бензальдегида (пик2) и синтез Штрекера из фенилацетальдегида (пик3)
с последующим разделением рацемической смеси при помощи ферментов.
Значительная часть фенилаланина идёт на производство дипептида аспартама — синтетического сахарозаменителя. Пик4.
А давай-ка ты подскажешь мне её.
Продолжаю...
>>16826
Метионин.
Промышленный синтез DL-метионина осуществляют исходя из акролеина.
На первой стадии присоединением метилмеркаптана к акролеину синтезируют 3-метилтиопропионовый альдегид:
CH3SH + H2C=CH-CHO → CH3SCH2CH2CHO
который далее используется в качестве карбонильного компонента синтеза Штреккера:
CH3SCH2CH2CHO + HCN + NH3 → CH3SCH2CH2CH(NH2)CN
CH3SCH2CH2CH(NH2)CN + H2O → CH3SCH2CH2CH(NH2)COOH
В лаборатории акролеин получается дегидратацией глицерина в присутствии гидросульфата калия.
В промышленности акролеин получают каталитическим окислением пропилена над оксидными висмут-молибденовыми катализаторами или оксидом меди.
Ранее в промышленности был распространён процесс парофазной кротоновой конденсации ацетальдегида с формальдегидом (устаревший метод):
CH2O + CH3CHO → CH2=CH−CHO + H2O
Треонин.
Синтез треонина осуществляют восстановлением 2-нитрозоацетоуксусного эфира или фенилазоацетоуксусного эфира,
альдольной конденсацией ацетальдегида с медной солью глицина, а также из кротоновой кислоты.
Реакций не нашёл, но более привлекательной реакцией, ИМХО, является выделенная, так как более доступные реагенты там.
Триптофан.
Для получения триптофана, индол аминометилируют формальдегидом и диметиламином по методу Манниха.
Полученный 3-диметиламинометилиндол конденсируют с метиловым эфиром нитроуксусной кислоты,
что приводит к метилату 3-индолилнитропропионовой кислоты. Затем восстанавливают нитрогруппу до аминогруппы.
После щелочного гидролиза эфира получают D,L-триптофан обычно в форме натриевой соли.
В триптофане, полученном химическим синтезом, обнаруживаются примеси токсичных соединений.
Синтетический триптофан добавляют в комбикорма для животных.
Обычно индол выделяют из нафталиновой фракции каменноугольной смолы или получают
дегидрированием о-этиланилина с последующей циклизацией образующегося продукта. Пикрелейтед.
Фенилаланин.
Фенилаланин в промышленных масштабах получают микробиологическим способом. Там какая-то ферментативная реакция.
Возможен также химический синтез - это синтез Эрленмейера из бензальдегида (пик2) и синтез Штрекера из фенилацетальдегида (пик3)
с последующим разделением рацемической смеси при помощи ферментов.
Значительная часть фенилаланина идёт на производство дипептида аспартама — синтетического сахарозаменителя. Пик4.
![1113-20[1].jpg](/sci/big/thumb/414180/14992554834010s.jpg) 12 Кб, 602x360
12 Кб, 602x360>>16837
Это были все незаменимые аминокислоты. Продукты, в которых они содержаться - есть здесь: >>405665
Аргинин. Химического синтеза - не нашёл. Имеется инфа только о ферментативном синтезе.
Фермент при ферментативном синтезе - непонятный. Мировое производство L-Аргинина - около 1200 тонн в год.
Аргинин можно получить, например при распаде аргининоянтарной кислоты - там образуются аргинин и фумарат;
последний должен быть превращен вновь в аспартат, чтобы цикл мочевины мог функционировать каталитически.
Источник: http://dommedika.com/phisiology/1268.html Dommedika
Аргининосукцинат (аргининоянтарная кислота) — не-протеиногенная аминокислота, образуемая в цикле мочевины.
Продукт реакции цитрулина и аспартата, потребляющая молекулу АТФ.
Гистидин. Только ферментативный и бактериальный биосинтез.
Биосинтез гистидина не осуществляется de novo в людях и других животных,
поэтому аминокислота должна употребляться в чистом виде или в составе других белков.
Просто оставлю это здесь:
Гистидин впервые был получен А. Косселем в 1896 г. из гидролизата протамина осетра — стурина
и в том же году Гедином (S. Hedin)— из гидролизата казеина.
Гистидин может быть получен и из гидролизатов других белков.
Много гистидина содержит глобин (белковая часть гемоглобина),
благодаря чему богатым источником для получения Г. служит кровь.
А. Коссель в 1896 году выделил гистидин из сернокислых гидролизатов стурина.
Отсутствие гистидина замедляет синтез гемоглобина и приводит к развитию анемии,
так как белковая часть гемоглобина требует относительно большого количества гистидина.
Алсо, нашёл следующее:
Выделяют гистидин из гидролизатов гемоглобина и крови
или синтезируют, например взаимодействием 5-хлорметилимидазола с ацетамидомалоновым эфиром.
Мировое производство L-гистидина - около 400 тонн в год. Преимущественно ферментативный синтез.
Вот: http://vansiton.ua/blog/promyishlennyiy_sintez_aminokislot.html
![1113-20[1].jpg](/sci/big/thumb/414180/14992554834010s.jpg) 12 Кб, 602x360
12 Кб, 602x360>>16837
Это были все незаменимые аминокислоты. Продукты, в которых они содержаться - есть здесь: >>405665
Аргинин. Химического синтеза - не нашёл. Имеется инфа только о ферментативном синтезе.
Фермент при ферментативном синтезе - непонятный. Мировое производство L-Аргинина - около 1200 тонн в год.
Аргинин можно получить, например при распаде аргининоянтарной кислоты - там образуются аргинин и фумарат;
последний должен быть превращен вновь в аспартат, чтобы цикл мочевины мог функционировать каталитически.
Источник: http://dommedika.com/phisiology/1268.html Dommedika
Аргининосукцинат (аргининоянтарная кислота) — не-протеиногенная аминокислота, образуемая в цикле мочевины.
Продукт реакции цитрулина и аспартата, потребляющая молекулу АТФ.
Гистидин. Только ферментативный и бактериальный биосинтез.
Биосинтез гистидина не осуществляется de novo в людях и других животных,
поэтому аминокислота должна употребляться в чистом виде или в составе других белков.
Просто оставлю это здесь:
Гистидин впервые был получен А. Косселем в 1896 г. из гидролизата протамина осетра — стурина
и в том же году Гедином (S. Hedin)— из гидролизата казеина.
Гистидин может быть получен и из гидролизатов других белков.
Много гистидина содержит глобин (белковая часть гемоглобина),
благодаря чему богатым источником для получения Г. служит кровь.
А. Коссель в 1896 году выделил гистидин из сернокислых гидролизатов стурина.
Отсутствие гистидина замедляет синтез гемоглобина и приводит к развитию анемии,
так как белковая часть гемоглобина требует относительно большого количества гистидина.
Алсо, нашёл следующее:
Выделяют гистидин из гидролизатов гемоглобина и крови
или синтезируют, например взаимодействием 5-хлорметилимидазола с ацетамидомалоновым эфиром.
Мировое производство L-гистидина - около 400 тонн в год. Преимущественно ферментативный синтез.
Вот: http://vansiton.ua/blog/promyishlennyiy_sintez_aminokislot.html
Ну и что ты мне дал?
Первая пдф-ка на 9 мегабайт, и там ни слова про ацетамидомалоновый эфир для синтеза гистидина.
Сам иди и читай это.
Сап наукач.
Поясните за фарм-факультет РХТУ.Думаю туда вкатываться,на магистратуру,будучи специалистом в другой отрасли.
Какие подводные.
да, как сбацать из доступных средств?
(4aR,4bS,6aS,7S,9aS,9bS,11aR)-N-[2,5-Bis(trifluoromethyl)phenyl]-2,4a,4b,5,6,6a,7,8,9,9a,9b,10,11,11a-tetradecahydro-4a,6a-dimethyl-2-oxo-1H-Indeno[5,4-f]quinoline-7-carboxamide; (5?,17?)-N-[2,5-Bis(trifluoromethyl)phenyl]-3-oxo-4-azaandrost-1-ene-17-carboxamide
И можно ли?
 6 Кб, 250x250
6 Кб, 250x250>(4aR,4bS,6aS,7S,9aS,9bS,11aR)-N-[2,5-Bis(trifluoromethyl)phenyl]-2,4a,4b,5,6,6a,7,8,9,9a,9b,10,11,11a-tetradecahydro-4a,6a-dimethyl-2-oxo-1H-Indeno[5,4-f]quinoline-7-carboxamide
>(5α,17β)-N-[2,5-Bis(trifluoromethyl)phenyl]-3-oxo-4-azaandrost-1-ene-17-carboxamide
Вот тут посмотри, нашёл что-то: http://www.chemspider.com/Chemical-Structure.5293502.html
Это вроде бы и первое, и второе вещество - одно и то же.
Можешь записать его простейшей химической формулой: C27H30F6N2O2,
или же названием вещества - Dutasteride, дутастерид.
Твои названия скорее отражают структурную формулу, пикрелейтед.
Наверное потому, что прежде чем испытать последствия лучевой болезни при активности радия в 37 ГБк,
стоило бы наверное заюзать циклопропан. Циклопропан оказывает сильное общеобезболивающее действие.
 83 Кб, 700x525
83 Кб, 700x525Это ЖУЙЧИКИ.
Ты мне еще поуказывай, хуйло ебаное. Раскомандовался, уебок. Вали обратно в свое б.
На тебе песенку Лешего:
https://www.youtube.com/watch?v=KeAph-5qSsc
Вингсьют:
https://www.youtube.com/watch?v=gRGrMB793Zw
Гайд по пилотированию в Battlefield:
https://www.youtube.com/watch?v=v-d9PLH-Lqo
и синтез LCD-телевизоров
http://drugscomru.info/node/586
Я у себя ютуб забанил, за их политику неправильную.
ссылка - всё сложно, я же просил попростому, но ты не отвечай, я двач в блоклист добавляю, этот сайт для грязных свиней для меня своё отжил.
Прощайте!
>ссылка - всё сложно, я же просил попростому
Зато синтез триптофана повыше >>16837, а синтез анилина >>414321 и бензола >>414446 - тут >>409352 (OP)
Всё, вали.
>Возможен также химический синтез - это синтез Эрленмейера из бензальдегида (пик2) и синтез Штрекера из фенилацетальдегида (пик3)
У тебя на обоих картинках одна и та же реакция, только на правой опущен бензиловый фрагмент. Алсо, лучше бы ты привёл энантиоселективный синтез АК.
![arch[1].gif](/sci/big/thumb/414180/14997983108380s.jpg) 5 Кб, 434x253
5 Кб, 434x253>У тебя на обоих картинках одна и та же реакция, только на правой опущен бензиловый фрагмент.
Да. Просто вытащил из гугла картинку по запросу "фенилаланин синтез Эрленмейера"
Поэтому оставлю здесь его суть и вот такую пикчу, её отражающую:
Синтез Эрленмейера
Получение циклических эфиров путем конденсации альдегида с ациламинокислотой
в присутствии ангидрида уксусной кислоты и ацетата натрия.
>Алсо, лучше бы ты привёл энантиоселективный синтез АК.
Ой бля, я его не знаю и в глаза не видел,
и вообще меня интересовал полный синтез аминокислот - чуть-ли не из простых веществ.
Думаю незаменимых аминокислот достаточно, потому что заменимые и частично-заменимые
как правило синтезируются в основмном в организме ферментативным биосинтезом.
энантиоселективный синтез - он же и есть Стереоселективный синтез, поэтому оставлю здесь это:
Стереонаправленный синтез α-аминокислот http://www.dissercat.com/content/stereonapravlennyi-sintez-aminokislot
Там куча литературы прилагается внизу - к этой диссертации.
 81 Кб, 604x386
81 Кб, 604x386Судя по формулировке поста для тебя никаких перспектив в образовании нет. И не только в химии.
ну как сказать, кафедры которые выигрывают гранты(например моя кафедра и мой научрук в особенности), у нас все неплохо, хотя мы даже не из первых двух ДСов(И даже не Казань), ездим по конференциям всяким, то в Москву, то в С-Пб, то вот в Лион катался, в журналах публикуемся, а если грантов нет, то пизда, пушшо вон на лабораторные по органике выделяют на семестр 30000 рублей, всмысле для 3ьего курса чтобы вести которые
Не знаю как химобр, но если пойдёшь на кафедру фармобра в химвузе перспективы в ДС-1 и ДС-2 крайне неплохие в плане работы на фармфабриках. Их сейчас десяток строится наших и иностранных.
Расскажи про фармфабрики. Неужто рашка просыпается от векового сна? Что выпускают?
Это ты на примере одной фабрики? Что значит "иногда заваливают простой синтез"? Халтурка по заказу, или в смысле что неправильно делают?
Ты в русский язык умеешь? Завалить синтез, если брать словарь, значит наполнить чем-то синтез до верха, переполнить его.
Во-первых, не слушай этого >>18038, во-вторых, в России большая программа импортозамещения, в которой прописана лазейка шириной с жопу мамаши любого анона, когда российским препаратом считается тот, который произведён на территории нашей страны, тогда он попадает в список ЖНВЛП и его закупают централизованно. Соответственно, вся бигфарма так или иначе начала залезать в Россию и строить тут свои заводы, или давать деньги местным заводам.
В-третьих, внезапно, у ВВП и его друзей есть друзья в российской фарме, а учитывая сколько вообще денег крутится в мире на лекарствах, то, разумеется и наши хотят урвать кусок хотя бы на рынке СНГ, сиречь много денег сейчас идёт и в разработку, и в заводы. В последние 2 года новое производство разных масштабов открывается каждые 2 недели (правда и старые загибаются, надо помнить).
В-четвёртых, Россия хочет перейти на евростандарт GMP в производстве, а это значит много бабла уйдёт на модернизацию и открытие новых линий, а старые производства закроются или перейдут на БАДы. В общем, в последнее время в химфармакадемии в СПб, как я слышал, все последние выпуски идут чуть ли не сразу на новые заводы в полном составе.
Как долго это продлится – сложно сказать, возможно в 2020 начнётся бум химической промышленности и всякие полимерщики вдруг окажутся на коне.
В России есть проблема с синтезом субстанций, основная масса импортная, которая потом пакуется в готовые таблетки (это собственно и есть производство препаратов), но импортозамещение должно сейчас начаться и там, так что возможно начнётся вскоре бум заводов субстанций.
Что до объёмов, то можно почитать тут:
http://www.dsm.ru/marketing/free-information/analytic-reports/
>В России есть проблема с синтезом субстанций, основная масса импортная, которая потом пакуется в готовые таблетки
А это значит, что фарм. химики там не нужны от слова совсем, особенно если разработки / синтеза на территории РФ нет. А нужны там химики-технологи.
Пруфов то нет, поэтому продолжаю.
 63 Кб, 800x800
63 Кб, 800x800Нет. Это холодильник для дистиллятора. Принцип тот же что и в самогонном аппарате. Что мне его бояться? Это лабораторный экстрактор будет.
Товарищ майор, из этого не курят.
Спиральный обычно юзают под вакуумом, ибо для него нужно давление хорошее, чисто чтоб ты знал. Бери шаровый и не придумывай.
 30 Кб, 550x486
30 Кб, 550x486Колба с двумя горловинами и какой-нибудь "Ручей-1", а то и вовсе старый пылесос через фильтр воткнутый во вторую горловину. Если выход без горючих паров, то наверно вообще можно просто выжигать воздух в приемной колбе. Только на сколько это оправданно? Видел модели дистилляторов со змеевиком без компрессора, холодильник расположен горизонтально под уклоном. Они продают нерабочие модели?
Это не значит что оно не будет работать без вакуума, будет. И да обычно юзают водоструйник, а уже за ними следит майор.
Насос что ли? Я недавно купил аквариумный за компанию с ультразвуковым генератором. Теперь здавать мочу на наркотики?
>и там ни слова про ацетамидомалоновый эфир для синтеза гистидина.
Малоновый путь синтеза для хуесосов.
>>18459
>Колба с двумя горловинами
Хуй найдёшь такое. А заказывать в русхиме - верный путь получить себе на дом маски-шоу, эти бляди всех клиентов отслеживают и сливают (пруфы на покойном пиротыке).
 38 Кб, 538x303
38 Кб, 538x303Так я же не варю ничего торкающего, не употребляю даже этила и судимостей не имею. Мне как бы фиолетово. Могу им бетулина из берёзовой коры отсыпать или соснового эфирного масла отлить с биодизелем.
Как вариант воткнуть две трубки через одну пробку.
Nilered.
Почему валентные углы у многих веществ не идеальные, ну т.е. не равны 109.5, 60, 90 и т.д.?
Ну хуй знает в теориях там должны быть тетраэдры, тригональная и пентагональная бипирамиды, плоский квадрат, октаэдр, линейные молекулы и т.д. с определенными углами, а на практике у некоторых веществ например у аммиака вместо тетраэдрического угла 109.5, 107 градусов, почему такая неидеальность происходит?
Как говаривал один человек, "если теория не соответствует практике то нахуй такую теорию". Этим человеком был альберт эйнштейн.
 200 Кб, webm,
200 Кб, webm,640x360, 0:01
Ты явно не по адресу вопрос задал, если не выдумал эту хуйню. Доебись до кого-нибудь на кафедре.
Я пока абитуриент, у меня органическая будет только на третьем курсе, я решил заранее изучать.
Вот и нехуй лезть в мастерские дела если ты даже не подмастерье.
Хуйня будет. Вэдэхой отмывай и не выёбывайся.
Коррозия будет.
Есть как минимум три спиральных холодильника: с внешним охлаждением, с внутренним охлаждением, с внутренним охлаждением Димрота. Там, где у тебя вакуум находится снаружи трубки или сферы - трубке будет пиздец, если трубка не охуенно толстая.
>>18461
>И да обычно юзают водоструйник, а уже за ними следит майор.
Нахуя майору водоструй? Через него разве курят?
>>18754
Есть же специальные методы, тема изучена вдоль и поперек, нахуй ты какую-то чушь выдумываешь?
Связано с симметрией. Вообще с химии много с ней связано. Если молекула имеет ось симметрии, то она не может быть уже хиральна. Хиральные обычно C1 молекулы.
>Нахуя майору водоструй? Через него разве курят?
Давненько на форуме юзверы сообщали что после покупки водоструйника приходил майор с обыском.
>Сложный синтез только осваивается.
А вот у хохлов...А что там по странам СНГ, в натуре, есть чё-где варить?
>пик
Страшновато смотрится, учитывая то, что даже слегка бракованный Бунзен может и на водоструйнике разлететься, а тут масляный насос хоть и под Бюхнер, но в любом случае в фулл рабочем состоянии такая система может взорватся как нехуй инфа 99%...
Там дело не только во взрывах, есть же всякие пары кислот и всякой хуйни типа амиака от которой сей компрессор прост развалиться к хуям. Так что водоструйник без вариантов, притом стеклянный.
 331 Кб, 800x682
331 Кб, 800x682там нечему валится от паров, если только не конденсат в ебических количествах, только вакуум может немного приуныть, и маслу будет пизда, а вот водкостуйник может внезапно обратную тягу дать если напор воды хоть чуточку "гуляет" и колба мокрая, с литрой воды будет. Мембранник - выбор дорогой, но надёжный, потому что рабочее тело - тефлоновая мембрана вместо масла - почти вечная, если правильно юзатьно всё-равно рвутся суки от попавших в систему твёрдых/жидких частиц и криворукости
 39 Кб, 450x373
39 Кб, 450x373Ты такую хуйню сказал, что я даже не знаю, с чего начать. Не лезь в пиротехнику, целее будешь.
>Базовый уровень достаточен для того, чтобы понять, с чем имеет дело химия и успешно сдавать экзамены (в том числе ЕГЭ) именно на основе такого понимания.
Можете, пожалуйста, покликать по главаммне базовый уровень нужен и пояснить, хороший же учебник или нет. Спасибо.
>Нужно изучить школьную химию. Учебники школьные брать не хочу
Изыди. На рынке тебе пригодится навык приветливости, чтобы можно было втихаря втюхать подгнившие помидоры.
По делу - выучи хотя бы уравнения реакций для ТОС, с которыми собираешься работать. Чувурина прочитай для начала, он простым языком пишет, даже такой ретард, как ты, должен понять.
>кокок ты дурак но ничо по делу не напишу вот читай книжки
Понятно, мог бы и не писать ничего вовсе.
Ну ладно, я честно пытался тебя предупредить, что ты лезешь не в ту область, тупое хуйло. Но раз ты так настаиваешь на том, чтобы подорваться на своём сраном фейерверке, то вот тебе "по делу": АЛЮМИНИЙ, БЛЯДЬ, ЭТО ТОПЛИВО. ОХУЕННО ЭНЕРГОЁМКОЕ ТОПЛИВО. ОН ГОРИТ, СУКА, СО ВЗРЫВОМ, И ПРИ ДОСТАТОЧНО ВЫСОКОЙ ТЕМПЕРАТУРЕ. И ПЛАМЯ ОН В КРАСНЫЙ НЕ ОКРАШИВАЕТ, ВООБЩЕ НИКАК. ОКСИД АЛЮМИНИЯ - ЭТО ЁБАНАЯ ГЛИНА, ОДНО ИЗ САМЫХ ХИМИЧЕСКИ ИНЕРТНЫХ ВЕЩЕСТВ, СРАВНИМОЕ ПО ИНЕРТНОСТИ С ОКСИДОМ КРЕМНИЯ, И В ТОСАХ НАХУЙ НЕ НУЖНО. А ТЕПЕРЬ ИДИ В ПИЗДУ, ЧТОБЫ ТЕБЕ ПАЛЬЦЫ НАХУЙ ОТОРВАЛО, ТУПОЕ ЧМО, И ЧТОБ ТЕБЕ В РЕАНИМАЦИИ ХУЙ НА ЛОБ ПРИШИЛИ. ТЕМ ВРЕМЕНЕМ Я НАССУ НА ЕБАЛЬНИК ТВОЕЙ МАМАШЕ-ШЛЮХЕ.
Потеплело?
Я же пояснил, что не хочу школьные, потому что чтобы освоить что-то нужно будет качать химию за 8 класс, за 9 и за 10 с 11 отдельно, а я хочу всё в 1 книжечке.
>Отсос хиккующих выблядков / просто неудачников типа физхимиков
кек. такой аутотренинг, ставить кого-то выше других, это просто показатель тупости. Ибо фундаментальная наука без практики и теории просто будет стоять на месте. Плюс любой уважающий себя химик, не должен упарыватьсся только в одну узкую область, сейчас так наука не работает. Пока ты будешь перебирать катализаторы или условия под тягой, коллега из Китая на кластере посчитает возможные варианты, сэкономит кучу времени, и еще понимание механизмов будет более полным.
Обычно от людей с подобными мыслишками исходит такой набор звуков, в сторону других областей.
>чё... грант всего в миллион, нихуя вы ло.. что евро?... зачем вам.. приборы? вы же дауны... ну ок, расскажи мне, что вы делаете...
ой мама... интеграл большой... непонятно... четырехмерное... чё? бля... ладно ща опущу. смотри что делаю... что... ты знаешь эту реакцию...чё ты и механизм знаешь... эй откуда ты знаешь органику, ты же даун физхимик? И мысли про себя... "пидоры-пидоры... гранты по миллиону евро... за что им платят, они даже растворитель не нюхали"
 163 Кб, 670x400
163 Кб, 670x400медный купорос
железный купорос
персульфат аммония
дихромат калия
хорид аммония
нитрат калия
ну и обычные реактивы, которые можно найти на кухне/купить в садоводческом магазине. Задача проста: химически воздействовать чем-то на железную поверхность, чтобы создать на ней более-менее стойкую чёрную плёнку.
Блять, какие же органики дегенераты, пиздец просто.
Очевидный карборунд на ней сделать из мамкиного масла с спички.
Какой-то невнятный всхрюк, неубедительно. На моменте с "обсчётом" вообще в голос проиграл, физхимики же дегенераты, неспособные вычислить нормально даже элементарную температуру кипения, все результаты с разбросом плюс-минус пятьдесят градусов.
>КУДАХ КУКАРЕК ИНТЕГРАЛЫ
Вот хуле толку от ваших сраных интегралов, если они никакого отношения к реальности не имеют?
![95BBUSK[1].jpg](/sci/big/thumb/414180/15035144555670s.jpg) 48 Кб, 550x259
48 Кб, 550x259Гугли чёрные соединения железа.
Вот что нашёл:
Оксид железа(II). Соединение черного цвета. Кристаллическая решетка по типу каменной соли.
Сульфид железа(II) — бескислородная соль. Кристаллы чёрного цвета с металлическим блеском и гексагональной кристаллической решёткой, тугоплавкий, разлагается при нагревании в вакууме.
Сулфаты и нитраты - не чёрные.
>Очевидный карборунд на ней сделать из мамкиного масла с спички.
Годно, но не карборунд. Карборунд, хоть и может быть чёрным, но представляет из себя Карбид кремния.
Ты натолкнул меня на мысль о использовании карбида железа.
Он называется цементит. Чёрный и достаточно твёрдый материал. Микротвёрдость - 7 по шкале Мооса.
Ну и где-то тут, неподалёку, была паста про него. А вот же она: >>418010
Пикрелейтед.
Речь шла о пылесосе. Чтобы не слишком быстро сдох. Эффективно отфильтровать пары и не сильно снизить тягу вряд ли получится.
>нормально даже элементарную температуру кипения, все результаты с разбросом плюс-минус пятьдесят градусов
Капчуешь из 80-x? Или ты из 17-го века, где только эмпирический опыт важен? Удачи чё.
>>19961
Довены, просто признайте реальность. Вычислительные методы - говно, ваши вычисления не стоят того электричества, которое на них тратится. А сейчас в фармакологии начинается век макромолекул, с которыми ваше ВЫЧИСЛЕНИЕ ПРОТЕИНОВ не справляется никак, от слова "совсем". Максимум, который способны высрать компьютеры - более-менее точные результаты для плоских и полярных молекул, и то там слово "точные" означает "разброс в 5 градусов", что даже для аналитиков является полным пиздецом. Нахуй вы вообще живёте, вскройтесь уже и не переводите зазря кислород.
ИМХО Ну наверно лучше кидать все силы на улучшение вычислительного метода если он так плох, это будет полезно на перспективу в будущем и можно будет прогнозировать свойства исследуемых веществ или узнать строение и состав вещества с задаными характеристиками, чем тратить всё время на метод эмперического тыка, нерационален он, он нужен только для сбора данных для улучшения вычислительных методов и теорий или когда нет никаких теорий и методов вычислений.
мимо
Ты нихуя не знаешь ни про фамру, ни про методы, ни про полимеры, ни про макромолекулы как таковые. Так что иди нахуй, дауненок-недоучка.
Наверни теорию оптимизации.
Что касется фосфатирования из треда >>419863 (OP)
Фосфат железа(II) образует белые кристаллы моноклинной сингонии.
Фосфат железа(III) — FePO4, жёлтые кристаллы, не растворимые в воде, образует кристаллогидраты.
На, ещё, держи несколько рецептов воронения стали:
http://www.lformula.ru/index.php?part=him008&page=010
Чёрный цвет:
1. Предмет погружают в 10% раствор двухромовокислого калия (хромпика) на 15-20 минут,
вынимают, просушивают на воздухе и держат в течение двух минут над сильно горящими, но не коптящими углями.
После первого раза получается черно-бурое окрашивание.
Если же эту операцию повторить несколько раз, то получается чистый черный цвет.
2. Предмет покрывают равномерным тонким слоем льняного масла или олифы и нагревают
над сильно горящим раскаленным древесным углем (без поддувала).
Слой масла при этом обугливается и сгорает. Операцию эту повторяют несколько раз.
После каждого нагревания и охлаждения предмет растирают сухой тряпкой.
В последний раз предмет нагревают слабо, а растирание производят тряпкой, смоченной в льняной олифе.
Очищенный предмет сначала подвергают протраве, т, е. его погружают на короткое время в смесь из
1 вес. ч. концентрированной серной кислоты и 20 вес. ч. воды.
Затем предмет промывают, просушивают и покрывают приготовленным на водяной бане раствором
1 вес. ч. серного цвета (мелкий порошок серы) в 16 вес. ч. скипидара,
затем предмет слегка нагревают, пока не образуется черный налет.
Я видел эти рецепты. Первые два отпадают, т.к. нельзя нагревать (к пластине припаяны на обычный припой стойки, которые в случае отпаивания на места точно уже будет не припаять). А вот третий метод заинтересовал, можно попробовать.
Кстати, да. Там сера в скипидаре, и с железом она образует сульфид.
Сульфид железа(II) - кристаллы чёрного цвета с металлическим блеском и гексагональной кристаллической решёткой,
тугоплавкий, разлагается при нагревании в вакууме.
Это покрытие должно быть похоже на твою блестящую деталь с пикчи.
вопросы:
1. чем можно протравить кроме серной кислоты? лимонная, уксусная не подойдут? есть ещё ортофосфорный преобразователь ржавчины, тоже подтравливает неплохо, но вроде как образует нерастворимый слой на поверхности.
2. до скольки градусов подогревать?
>чем можно протравить кроме серной кислоты?
Соляной, например. Хлориды железа хорошо растворимы в воде.
Цитраты железа (соли лимонной кислоты) тоже растворяются, но железо не очень активно реагирует с лимонной кислотой.
Обычно для их получения используется порошковое железо или гидроксид железа.
С ацетатами (соли уксусной кислоты) - та же хуйня.
К тому же Ацетат железа(III) не растворим в воде.
>есть ещё ортофосфорный преобразователь ржавчины, тоже подтравливает неплохо, но вроде как образует нерастворимый слой на поверхности.
Да, фосфаты не растворимы.
Фосфат железа(II) - белые кристаллы, не растворимые в воде.
Фосфат железа(III) - желтые кристаллы, не растворимые в воде.
Важно понять, что протравливание необходимо для растворения различных оксидов и гидроксидов железа на поверхности металла,
в местах, где сложно зашкурить например. Это надо, чтобы металлическое железо активнее образовывало сульфид с мелкодисперсной серой.
Вообще-то, если деталь гладкая, можно было бы и мелкой наждачной бумагой пройтись (нулёвка).
Поэтому, если не хочешь шкурить, можешь получить соляную кислоту.
Бёрешь короче соль обычную кухонную, два электрода туда, проводишь электролиз,
хлор и водород собираешь отдельно, потом сжигаешь хлор в водороде: https://www.youtube.com/watch?v=vlpK-i-7-Bk
а хлороводород - растворяешь в воде. На выходе - соляная кислота. Тут есть ньюансы.
Надо выпрямитель, и постоянный ток. Иначе, при переменном токе будет смесь хлора с водородом,
а эта смесь напоминает гремучую смесь и взрывается при освещении с образованием хлороводорода.
Поэтому, чтоб не городить хуету из пробирок - лучше взять электролит, упарить его,
получить концентрированную серную и развести в нужных пропорциях для протравы.
Дело в том, что при сильном нагревании порошкообразного железа с серой -
образуется не сульфид, а дисульфид железа:
Fe+2S -> FeS2
Который потом разлагается при 1170 градусах:
FeS2 -> FeS+S
Дисульфид железа - это светло-жёлтые или тёмно-жёлтые кристаллы, нерастворимые в воде.
А вот сульфид железа - черный и имеет металлический блеск.
А у тебя припой, я гляжу. Я бы просто покрасил и всё.
Но можешь прогреть, и пускай отпаяется всё нафиг,
а потом посадить на клей из галлия и порошкообразной меди.
Галлий реагирует с медью так, что образуется интерметаллид, который не плавится даже при 600 градусах.
И это было бы похлеще, чем обычный припой, к тому же будет жидким некоторое время,
что позволило бы правильно склеить это всё. Но лучше сначала - поэксперементировать.
Хотя постой. У тебя там где-то была лимонная кислота.
Так что на тебе вот это: https://www.youtube.com/watch?v=nlL2fuNaSh0
На ещё вот это: http://gorod.crimea.edu/librari/okraska.htm
Окраска в буровато-черный цвет (Мацумото-рю).
и дальше почитай.
>Я бы просто покрасил и всё
Трижды красил. Руки из жопы, поэтому все три раза получалось ужасно из-за пыли, которая налипает во время покраски.
В конце концов смыл всё и ищу методы химического черенения. Сейчас два опытных образца положил в растворы лимонной и уксусной кистлот. Денёк подержу, посмотрим.
Кстати, цитрат железа же растворим в воде, значит для защиты придётся покрывать лаком. А это опять пыль во время покраски и всё на смарку...
Мог бы зачитать оттуда - пятый пункт. Это больше похоже на покраску, нежели на чернение.
Зацитирую его здесь:
Окраска в черный цвет (все школы).
В полстакана скипидара (терпентинное масло) по каплям вливают концентрированную серную кислоту,
каждый раз хорошенько размешивая стеклянной палочкой или трубочкой;
при этом на дне оседает черная масса.
По временам приливают в стакан немного свежего скипидара.
Когда получится с 1/4 стакана черного осадка, то стакан оставляют на несколько часов, чтобы в покое осадок отстоялся поплотнее.
Затем весь скипидар с осадка осторожно сливают, наливают вместо него воды, в которой стеклянной палочкой размешивают осадок,
и затем опять дают ему отстояться, а воду осторожно сливают.
Такое промывание осадка чистой водой повторяют раз по 12 - 15, пробуя, вся ли кислота обмыта
(если опущенная в воду полоска лакмусовой бумаги из лиловато-розовой станет чисто-розовой, значит, следы кислоты еще не отмыты).
Когда кислота отмыта, переливают осадок на чистую, тонкую полотняную тряпочку и отцеживают сквозь нее воду.
Затем осадок наносят на клинки, лучше всего плотной щетинной щеткой около 2 111 см шириной, как можно равномернее.
Если по густоте осадок ложится неровно, надо прибавить немножко скипидара и тщательно размешать его с осадком,
если же осадок слишком жидок и стекает с клинка, нужно осадок выпарить над спиртовой лампочкой.
Хорошо сделанный осадок кроет клинки ровным, просвечивающим, темнокоричневым слоем.
Обмазав клинки, надо их нагреть, равномерно, правильно и медленно поворачивая над огнем.
По мере нагревания коричневый цвет заменяется черным, более матовым.
Когда чернота легла равномерно, дают клинкам медленно остыть, и пока они все-таки еще теплы,
их протирают тряпочкой с небольшим количеством олифы и дают просохнуть несколько дней.
А потом можешь и лаком вскрыть.
Можно ли его использовать в качестве накопителя водорода?
Ну да, куча водорода и куча поменьше кислорода, не?
![image233[1].jpg](/sci/big/thumb/414180/15039459986810s.jpg) 13 Кб, 455x225
13 Кб, 455x225>Антоны, каким образом можно разложить пероксид водорода на водород и кислород?
Если хочешь кислород - вот тебе оксид марганца, в качестве катализатора:
https://www.youtube.com/watch?v=u6vM5TIfu9g
2H2O2 -> 2H2O + O2
А дальше в образующейся воде растворяешь щелочь какую-нибудь и проводишь электролиз,
для получения водорода.
>Можно ли его использовать в качестве накопителя водорода?
Скорее кислорода. Иначе лучше вода, у неё на одну молекулу два атома приходится, и масса меньше.
У пероксида водорода в два раза больше кислорода же, и молекула тяжелее.
Алсо, тут посмотри: https://ru.wikipedia.org/wiki/Хранение_водорода
там внутри ссылка на куриные перья https://www.gazeta.ru/science/2009/06/24_a_3214875.shtml
Хм, если бы перья были реально успешными, то их наверное уже стали применять бы.
Дело в том, что водород лёгкий, у него атомная масса 1, а молекулярная масса 2 а.е.м.
Масса 1 кубического метра (1 м3, куба, кубометра) газообразного водорода
при барометрическом давлении 760 мм.рт.ст. и температуре 0°С равна 0,08988 кг или 89,88 грамм.
Масса 1 м3 жидкого водорода при температуре -253°С (20 К) равна 70,99 кг.
Я не знаю, откуда ты взял число 1.7%, но, короче, если в этих карбонизированных перьях
действительно запасается лишь 1.7% водорода по весу (по массе), то
(89,88 [грамм] / 1,7 [%]) × 100[%] = 52,870588235294117647058823529412 [г/%]× 100 [%] = 5287,06 г ~ 5.3 кг.
Что-то вроде обычной перьевой подушки. А если хорошо запрессовать всё это дело, и оставить пористым,
то может получиться более плотная структура наподобие активированного угля.
Ну и конечно же, адсорбция водорода в таком накопителе - должна быть обратимой,
например при нагревании всей этой байды.
>в этих карбонизированных перьях
>может получиться более плотная структура наподобие активированного угля.
Оно, походу, так и есть.
Ведь если загуглить что такое карбонизация - становится очевидным наличие угля в качестве продукта реакции.
Просто юзаются перья, чтобы обеспечить максимальную площадь контакта
этого вполне себе активированного угля - с газообразным водородом для последующей его адсорбции.
Прессовать такие структуры, ИМХО, не есть гуд,
потому что они ужмутся и площадь контакта может быть уменьшена.
Тогда уж газообразным водородом такую шнягу будет трудно зарядить, хотя,
вполне возможно - можно было бы и спрессовать, но если потом всё это залить жидким водородом,
с последующим снижением испаряющегося газообразного водорода.
Тогда, по идее всё полностью пропитается и большая часть водорода
останется адсорбированной внутри дебрей этих микроструктур.
А если подогреть слегонца - водень вроде должен выйти наружу.
Просто оставлю это здесь:
Открытый Фридрихом Бергиусом процесс гидротермальной карбонизации
воспроизводит в ускоренном виде процесс образования ископаемых углей.
В результате гидротермальной карбонизации в течение суток или меньше
при температуре порядка 200 и добавлении катализатора
биомасса превращается в так называемый биоуголь.
>1.7% водорода от веса пера
>>20339
>Я не знаю, откуда ты взял число 1.7%
Таки не пиздишь.
https://lenta.ru/news/2009/06/24/feather/
Оказалось, что сложная система внутренних полостей перьев способна хранить водород,
масса которого составляет примерно 1,7 процента массы перьев.
По словам исследователей, этот показатель близок к показателю углеродных нанотрубок,
которые в настоящее время являются самым перспективным материалом для хранения H2.
Кроме этого структурный анализ позволил определить,
что и по прочности обработанные перья сравнимы с нанотрубками.
Из этого всего можно сделать вывод, что там образовываются сами нанотрубки.
Хранение водорода в нанотрубках я уже где-то видел
>>412140
>Вот здесь магнитным полем вышибают атомарный водород при электролизе, вгоняя его в нанотрубки
Но это атомарный водород и он ещё более реакционноспособный, нежели молекулярный.
А вот что касается массовой части водорода в водородном накопителе,
просто оставлю это здесь:
Добились успеха в этом Adam Phillips и Bellave Shivaram — они описали процесс синтеза
композитного вещества на основе металлического титана,
у которого способность сорбировать до 12,4 % водорода (массы).
Вот он, этот процесс: http://zoom.cnews.ru/rnd/news/top/najden_novyj_material_dlya_hraneniya_vodoroda
Сначала титан испаряли в атмосфере этилена, где, по-видимому,
происходит образование связи между отдельными атомами титана и молекулами этилена
(возможно соединение одного или двух атомов Ti с одной молекулой этилена).
Образующиеся в газовой фазе соединения осаждали на поверхности датчика поверхностных акустических волн,
с помощью которого определяли нанограммовые количества связанного водорода.
Короче, надо титан и этилен.
А если нет титана - можно из кальция его получить последовательностью ядерных реакций: >>413132
>1.7% водорода от веса пера
>>20339
>Я не знаю, откуда ты взял число 1.7%
Таки не пиздишь.
https://lenta.ru/news/2009/06/24/feather/
Оказалось, что сложная система внутренних полостей перьев способна хранить водород,
масса которого составляет примерно 1,7 процента массы перьев.
По словам исследователей, этот показатель близок к показателю углеродных нанотрубок,
которые в настоящее время являются самым перспективным материалом для хранения H2.
Кроме этого структурный анализ позволил определить,
что и по прочности обработанные перья сравнимы с нанотрубками.
Из этого всего можно сделать вывод, что там образовываются сами нанотрубки.
Хранение водорода в нанотрубках я уже где-то видел
>>412140
>Вот здесь магнитным полем вышибают атомарный водород при электролизе, вгоняя его в нанотрубки
Но это атомарный водород и он ещё более реакционноспособный, нежели молекулярный.
А вот что касается массовой части водорода в водородном накопителе,
просто оставлю это здесь:
Добились успеха в этом Adam Phillips и Bellave Shivaram — они описали процесс синтеза
композитного вещества на основе металлического титана,
у которого способность сорбировать до 12,4 % водорода (массы).
Вот он, этот процесс: http://zoom.cnews.ru/rnd/news/top/najden_novyj_material_dlya_hraneniya_vodoroda
Сначала титан испаряли в атмосфере этилена, где, по-видимому,
происходит образование связи между отдельными атомами титана и молекулами этилена
(возможно соединение одного или двух атомов Ti с одной молекулой этилена).
Образующиеся в газовой фазе соединения осаждали на поверхности датчика поверхностных акустических волн,
с помощью которого определяли нанограммовые количества связанного водорода.
Короче, надо титан и этилен.
А если нет титана - можно из кальция его получить последовательностью ядерных реакций: >>413132
>возможно соединение одного или двух атомов Ti с одной молекулой этилена
Похоже на тетраэтилсвинец: https://ru.wikipedia.org/wiki/Тетраэтилсвинец
Только что за соединение - непонятно. У титана степень окисления: +2, +3, +4; валентность: 2, 3, 4.
Но тетраэтилсвинец кипит при 80 °C, и является летучей ядовитой жидкостью.
И вообще, они вроде как не поняли как обратить адсорбцию, т. е. водород там связывается крепко.
Если вода из-под крана, то это скорее всего сульфат кальция выпал. И соль если не "экстра", то там до трёх процентов примесей всякой фигни допускается, которая при сульфатировании тоже могла дать осадок.
Вода из-под крана, соль тоже с антислёживающим компонентом, но объём осадка составляет половину сумарного объёма ёмкости! Ладно, буду пробовать фильтровать.
Какого цвета хлопья?
Думаю, так кажется только пока они по банке болтаются. Посмотри на толщину слоя когда отфильтруешь и высушишь.
Тогда просто слегка подогреть надо, если растворится - то она.
сначала надо разобраться зачем нужен гем, гемоглобин, магний и хлорофилл. гемоглобин -- комплекс белка и порфирина с двухвалентным железом. служит для транспорта кислорода по организму животного. железо присоединяет этот самый кислород. хлорофилл, как ты сказал, примерно тоже самое, только атом магния там служит отчасти собирателем солнечной энергии. а у грибов нет нихуа, кислород они получают всей поверхностью мицелия, а фотосинтезировать не умеют и подавно. и вообще все эти сравнения крови, цитоплазмы растений и сделанные на основе этого выводы, что у грибов тоже есть что-то этакое ошибочны. так как кровь -- это целая ткань с клетками. цитоплазма -- компонент клетки. тут надо не путать теплое с мягким и не обобщать. все это совершенно разные вещи, несущие свою функцию у данного вида организмов. единственное что может быть у грибов -- так это пигменты в цитоплазме, выполняющие функцию защиты от уф-излучения, например. но это уже совсем другая история и сравнивать все же не стоит подобные вещи.
может ли портится со временем диметилсульфоксид (хч), комнатная температура и отсутствие света. и есть ли возможность его очистить, если да?
воду жрет, может еще окислиться до сульфона. немножко.
Двуокись кремния не портится тысячелетиями, я гарантирую это.
Что можно почитать о взрывчатых веществах?
Поваренную книгу.
Неодинаковость заместителей.
в теориях "на пальцах" да. В теориях нормальных, всё соотвествует действительности очень и очень точно.
Нет, угол в 109.5 получен на пальцах. Это просто угол в правильном тетраэдре. Это приближение о том, что электронные пары хотят отталкиваться. Если реально считать на компе, то в зависимости от методов, и времени расчета, получишь различную точность. Для простых молекул часто выходит точность до 0,01A для длинн связи, и 0,2 градуса для угла, на простом методе. Сложный я не ставил, так как не хочу неделю мариновать свой процессор.
В метане все заебись. 109.5 он же Td
Ну и чего в них суперского, я спросил? Что будет, если в неё железку или руку опустить, или небо с алахом - моментально разъест?
Короче, ща поясню. Есть такое определение кислот. Как доноры протона. Фактически кислота. Это вещество, которое пытается втюхать всем другим ион водорода. Обычные кислоты растворяясь в воде втюхивают свой протон молекуле воды. И в приниципе делают это с различной силой. Но есть соединения, которые готовы сунуть протон вообще блять куда угодно. Их назвали суперкислотами. Фактически, они протонируют даже углеводороды. Они настолько охуенно втюхивают протон, что алканам (а у них нету лишних электронов, все на связях) приходится рвать свои связи, чтобы этот протон на себя засунуть.
Теперь по поводу азотки и подобного. Азотку юзают, так как она 1) дешевле во много раз
2) она больше нужна как окислитель, нежели как донор протона. Она должна забирать электроны, вот и всё. Она просто сжигает вещества.
Чувурина читай.
Не наука.
Сейчас бы беспруфной манькой быть
А она разъедает оксидную/солевую плёнку, которой окружают себя металлы при реакции?
Так же как и обычные кислоты. Да.
Просто открой таблицу констант диссоциации кислот сильнее серной. У йодоводородной pKa ~ -10, то есть примерно в 10^8 раз сильнее, чем серная. Вся магия разсеивается, когда ты изучаешь химию.
http://100ballov.kz/mod/page/view.php?id=3016
Дай наименования веществам, запомни их, запомни осадки,
запомни реакции разложения нашатырного спирта и угольной кислоты,
и главное газы, которые выделяются при этом.
Запомни свойства газов, чтоб легко их распознать,
Запомни, что активный металл с сильным кислотным остатком - образует как правило растворимые соли с ионной связью,
которые будут в растворе и не выпадут в осадок.
Выпиши реакции, без ионных уравнений и подчеркни продукт качественной реакции.
Загугли его свойства и выпиши себе, чтоб крепче запомнить.
>ырного спирта и угольной кислоты,
>и главное газы, которые выделяются при этом.
>Запомни свойства газов, чтоб легко их распознать,
>Запомни, что активный металл с сильным кислотным остатком - образует как правило растворимые соли с ионной связью,
>которые будут в растворе и не выпадут в осадок.
>Выпиши реакции, без ионных уравнений и подчеркни продукт качественной реакции.
>Загугли его свойства и выпиши себе, чтоб крепче запомнить.
Пиздец. я кажется понимаю, почему школота не любит химию в школе... Они это учат? Хуемое
>Они настолько охуенно втюхивают протон, что алканам (а у них нету лишних электронов, все на связях) приходится рвать свои связи, чтобы этот протон на себя засунуть.
Что? Протон же просто вклинивается в одну из связей.
А как ты предлагаешь ему легче запомнить качественные реакции, не зубря уравнения?
Я оставил ему основную закономерность, которая позволяет предсказать будет ли соль после обменной реакции осадком или нет.
Ещё добавлю от себя, что легче запомнить - это провести ассоциации между выявляемым ионом и продуктом-индикатором - через реагент.
NH4++ щелочь -> NH3↑
Cu2++ щелочь ->Cu(OH)2↓
SO42- + растворимые соли бария = BaSO4↓
(Cl-, Br-, I-) + растворимые соли серебра -> AgCl↓, AgBr↓, AgI↓
CO32- + сильные кислоты -> H2CO3 -> CO2↑+ H2O
>>21051
Нука давайте мне, умники:
PbCl2 + HCl => HPbCl3
CaSO4 + H2SO4 => CaHSO4
NaCl + NH4CO3 => NaHCO3 + NH4Cl
Мне кажется. что адекватных химиков тут вообще нету, это ж саентач. Одна школота, которой нужно шпоры делать, а не учить хуету, которую они все равно никогда не запомнят, да зубрилки, которые уже все это выучили, и теперь шпыняют школоту, мол "хули такой тупой, все ж ясно тут".
тут да, мало химиков. Но вроде есть, даже в b вроде встречал. Тут обычно просто какой-то серун сидит, который на любой вопрос копипастит ответ из гугла.
Что за реакции ты написал? Там скорее всего такие:
PbCl2 + HCl = H[PbCl3]
CaSO4 + H2SO4 = Ca(HSO4)2
NaCl + (NH4)2CO3 => Na2CO3 + 2NH4Cl
нене, последняя у него
NaCl + (NH4)2CO3 => NaHCO3 + NH4Cl+NH3
Она протекает тупо из-за малой растворимости гидрокарбоната натрия, её используют в процессе Сольве, промышленный способ получения соды.
Ясно, благодарю. А то я вообще видел какое-то такое соединение в гугле: (NH4)2Cl
Чё там только не напишут... =)
Ещё глинянные таблички посоветуй, там ещё больше неактуального к исправлению, лол.
Что вообще может быть неактуального в реакциях того уровня что здесь?
PbCl2 + HCl = H[PbCl3]
А чего до конца не дописали, ведь в основном же должен быть анион [PbCl4]2-?
Это всё можно автоматизировать, надо только нейросети поцепить для распознвавания хуйни, ну и вместо килоденег - ватты тока подавать, лол.
>>21081
Ну если ты дохуя владелец директора директрис владельцев - ты бы не правил какие-то там реакции школотронов на двощах.
Наверное про это.
>>21083
>[PbCl4]2-
Да, есть и такое, вот нарыл короче H2[PbCl4]:
PbCl4+2HCl -> H2[PbCl6]
https://ru.wikipedia.org/wiki/Хлорид_свинца(IV)
Там и то и то в принципе плавает, опять же зависит от концентрации же. У олова на трех уже всё, больше не лезет. сейчас посмотрел на распределительную диаграмму для свинца, подбавить хлорида, и можно и 4 дать.
>>Да, есть и такое, вот нарыл короче H2[PbCl4]:
>>PbCl4+2HCl -> H2[PbCl6]
Да нет, я про хлоридные комплексы иона Pb2+.
Там анон написал, что образуется в существенных количествах только [PbCl3]-, я с этим не согласен, по-моему должен [PbCl4]- быть в существенных количествах.
А в литературе на эту тему разброд. Все по разному говорят.
 54 Кб, 551x395
54 Кб, 551x395Править реакции для школоты, это невинное хобби. Ты так это описал, будто это какое-то пиздец сложное занятие. Иди накинься так же на погромизда, который кому-то в инете даст совет, как перезагрузить комп.
>>21088
Я знаю что тебе надо! Это точно остановит все споры, литература прекрасно. Но у нас же есть источники.
Ну как видно, в одномолярке будет побольше тройки, и только в конц солянке будет почти чистая четверка. Ну собственно противоречивые данные в книгах не удивительно, хотя в таких случаях, почему бы им просто не пихать диаграмму.
https://www.youtube.com/watch?v=-fRNvxQL5aI
Не успев нырнуть.
 236 Кб, webm,
236 Кб, webm,640x360, 0:02
>Как быстро умрёшь, если нырнуть в ванну с диметилртутью?
У-ти какой извращенец! Вебм-релейтед!
Для начала... Эта бесцветная жидкость является одним из сильнейших нейротоксинов.
А терь - паста из википедии, специально, экстерном - для тебя:
Диметилртуть - чрезвычайно опасна. Продемонстрирована смертельность дозы всего в 0,05—0,1 мл.
Риск ещё более увеличивается в силу высокого давления паров этой жидкости.
Диметилртуть быстро (за секунды) проникает через латекс, ПВХ, полиизобутилен и неопрен, и впитывается через кожу.
Таким образом, большинство стандартных лабораторных перчаток не являются надёжной защитой,
и единственным способом безопасно обращаться с диметилртутью является использование высокозащищённых ламинированных перчаток
под вторыми, доходящими до локтя неопреновыми или иными толстыми защитными перчатками.
Отмечается также необходимость ношения длинного лицевого щитка и работы под вытяжным колпаком.
Токсичность диметилртути была ещё раз подчёркнута смертью химика-неорганика Карен Веттерхан (англ. Karen Wetterhahn),
последовавшей через несколько месяцев после того, как она пролила несколько капель соединения себе на руку, одетую в перчатку из латекса.
Диметилртуть легко преодолевает гематоэнцефалический барьер, вероятно, благодаря образованию комплексного соединения с цистеином.
Она очень медленно выводится из организма, и,
таким образом, имеет тенденцию к биоаккумуляции.
Симптомы отравления могут проявляться месяцы спустя, зачастую чересчур поздно для эффективного лечения.
А вот что касается паров самой ртути - они ядовиты. То, что чел на видео пьёт ртуть - не удивительно, ведь она связывается в организме.
В качестве пруфа - принесу это:
Интенсивное связывание ртути с твердыми взвешенными частицами приводит к тому, что фактор концентрирования составляет величину
порядка 1,3–1,8ч105,
т.е. доля ртути, связанной со взвешенными частицами (размером менее 0,45 мкм),
в 10 тыс. раз больше, чем растворенная доля.
http://eco.chem.msu.ru/rtut
Можешь закопировать эту страницу - пока не удалили. И домен, и IP, и сервер - мудачьё блядь.
Всё, нихуя не напишу более - пошли нахуй, суки ебучие. Пойду лучше дрочить. Причём так и только так. Детерминированно.
 236 Кб, webm,
236 Кб, webm,640x360, 0:02
>Как быстро умрёшь, если нырнуть в ванну с диметилртутью?
У-ти какой извращенец! Вебм-релейтед!
Для начала... Эта бесцветная жидкость является одним из сильнейших нейротоксинов.
А терь - паста из википедии, специально, экстерном - для тебя:
Диметилртуть - чрезвычайно опасна. Продемонстрирована смертельность дозы всего в 0,05—0,1 мл.
Риск ещё более увеличивается в силу высокого давления паров этой жидкости.
Диметилртуть быстро (за секунды) проникает через латекс, ПВХ, полиизобутилен и неопрен, и впитывается через кожу.
Таким образом, большинство стандартных лабораторных перчаток не являются надёжной защитой,
и единственным способом безопасно обращаться с диметилртутью является использование высокозащищённых ламинированных перчаток
под вторыми, доходящими до локтя неопреновыми или иными толстыми защитными перчатками.
Отмечается также необходимость ношения длинного лицевого щитка и работы под вытяжным колпаком.
Токсичность диметилртути была ещё раз подчёркнута смертью химика-неорганика Карен Веттерхан (англ. Karen Wetterhahn),
последовавшей через несколько месяцев после того, как она пролила несколько капель соединения себе на руку, одетую в перчатку из латекса.
Диметилртуть легко преодолевает гематоэнцефалический барьер, вероятно, благодаря образованию комплексного соединения с цистеином.
Она очень медленно выводится из организма, и,
таким образом, имеет тенденцию к биоаккумуляции.
Симптомы отравления могут проявляться месяцы спустя, зачастую чересчур поздно для эффективного лечения.
А вот что касается паров самой ртути - они ядовиты. То, что чел на видео пьёт ртуть - не удивительно, ведь она связывается в организме.
В качестве пруфа - принесу это:
Интенсивное связывание ртути с твердыми взвешенными частицами приводит к тому, что фактор концентрирования составляет величину
порядка 1,3–1,8ч105,
т.е. доля ртути, связанной со взвешенными частицами (размером менее 0,45 мкм),
в 10 тыс. раз больше, чем растворенная доля.
http://eco.chem.msu.ru/rtut
Можешь закопировать эту страницу - пока не удалили. И домен, и IP, и сервер - мудачьё блядь.
Всё, нихуя не напишу более - пошли нахуй, суки ебучие. Пойду лучше дрочить. Причём так и только так. Детерминированно.
Ололо, прозрел слегонца с описаний и как вас лошат этими описаниями. Я тебя помню оттуда ещё.
Описания формируют предписания к продавливанию. Принцип Юма оставлю здесь.
Он утверждает, что невозможно перейти от описательных суждений к предпиательным - логически. Значит логика поломана, как и психика.
А теперь, пиздуйте делать чип. Так сказал царь, И ПОШЁЛ СЕБЕ... Царь сказал - значит надо делать. А то пизда вам нахуй, блядь. А как мне их ещё мотивировать?
>То, что чел на видео пьёт ртуть - не удивительно, ведь она связывается в организме.
В качестве пруфа - принесу это:
Интенсивное связывание ртути с твердыми взвешенными частицами приводит к тому, что фактор концентрирования составляет величину
порядка 1,3–1,8ч105,
т.е. доля ртути, связанной со взвешенными частицами (размером менее 0,45 мкм)
Был бы твоим преподом, отправил на пересдачу по химии, откуда ты там, из медицинского? Ты хоть сам понял какой бред написал? Горит от жопочтецов.
Блять, я читал всё это. Тёлка умерла за год от капельки. А я спрашиваю про полное обмазывание, наверняка помрёшь быстрее, вот и хочу знать, насколько. На ютубе среди всякого говна "что будет если..." не нашёл
Бля, я вчера набухался просто.
>>21204
Вот тут посмотри какие клетки поражает и как: http://chemister.ru/Database/properties.php?dbid=1&id=162
Симптомы острого отравления.
Всякая органика со ртутью. Самая наверное диметилртуть.
ну ты и блять сука взбесил сейчас... Тебе что? Это место для выкладывания домашки? Иди нафиг школяр. Тебе тут сейчас насоветуют говна. И будут правы.
Это блять, школьный курс (если школа не из села). Ты попутала блять тематику, тебе в /un а ты в /sci
Эти два точно ароматичны, так как правило Хюккеля 4n+2 электрона
Этот ебаный маразм с 2мя номенкратурами еще не кончился, ебаный свет блядские выродки.
Чей учебник по общей химической технологии лучше ("лучше" - в котором больше информации по теме) : Амелина, Мухлёнова, Бескова, Кузнецовой или вообще какого-то другого автора?
>Это блять, школьный курс (если школа не из села).
Да ты ёбу дал. У меня был физмат лицей с довольно продвинутой химией, но из перечисленного у нас была только номенклатура и поверхностный ввод в циклические углеводороды (про общую орбиталь нам рассказывали, но по Хюккелю мы их не разбирали). Соответственно, и задач на энергетический потенциал таких реакций не было.
Либо это какая-то спецшкола для юных химиков, либо ты всё-таки ёбу дал.
Очевидно я имел ввиду под "не из села" в переносном смысле, а не в прямом. На направлениях химии в какихнибудь сунцах, такое должны давать.
Не я всё понимаю, но приходить сюда с вопросом, ответ на который даст почти публикацию в Science. На что ты надеешься?
Забавные там задачки, интересно пустят ли проверяющим туда. Ну раз с юных химиков, то там дикие можно предлагать, я думал тебе что-то прям реально практическое надо. Первое что просится на ум, это лазером нужной длины волны, сбивать связи нужные, всё в атмосфере водорода, чтобы сразу радикалы соединялись. И отслеживать под микроскопом электронном.
Чубарову привет
Предлагаю гандона, который дал эту задачу, посадить вырезать ароматику из графена, пока у него не получится. А потому прийти, когда ему будет лет семьдесят и он все еще будет биться над задачей, и спросить "ну что, будешь еще мудацкие задачки давать школьникам?".
Два чаю. Про молярную массу, сука, взбесило вообще.
>Не думаю, что это школьный курс, ушлепок.
Но это школьный курс. В школе нам рассказывали и про ИЮПАК, и про сопряжение, и про ароматичность с правилом Хюккеля, и про окисление алкенов, и про электрофильное замещение в ароматике. Добавьте уже в шапку ссылку на школьный учебник, чтобы больше не было вопросов.
Самое простое - раствор повареной соли, но я не могу понять, реагирует ли он с алюминием.
>Самое простое - раствор повареной соли, но я не могу понять, реагирует ли он с алюминием.
С алюминием реагирует почти всё. С оксидной плёнкой, которой он покрыт - мало что. Как вообще звучит твоя задача? Ты хочешь нанести алюминиевое покрытие?
Расплавленный криолит, собсвенно то же самое, что и при производстве алюминия. погугли
>Нужен электролит, который не реагирует с алюминием в обычных условиях (без протекания тока).
>Т.е. мне нужна жидкость, которая проводит ток и не вступает в остальное время в реакцию с алюминием.
>Самое простое - раствор повареной соли, но я не могу понять, реагирует ли он с алюминием.
Раствор поваренной соли содержит в себе воду, а вода активно взаимодействует с алюминием,
если разрушена оксидная плёнка. Например при амальгамировании.
https://www.youtube.com/watch?v=YQF0R6UNE1A
Поэтому, этот прав: >>21598
>>21600
>Расплавленный криолит
хоть и является электролитом, но всё-же при нормальных условиях - криолит твёрдый.
>собсвенно то же самое, что и при производстве алюминия
Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6
с последующим электролизом с использованием расходуемых
коксовых или графитовых анодных электродов.
Т. е. оксид алюминия растворяется в расплавленном криолите, а сам алюминий - нет,
потому что, как видно из химической формулы криолита - этот алюминий уже содержится в нём в достаточном количестве.
Но тебе же надо жидкий электролит.
Поэтому предлагаю глянуть в сторону комплексного соединения
хлорида 1-этил-3-метил-имизадолия с хлоридом алюминия,
которое имеет формулу [EMIM]+AlCl4−
Так как это вещество уже содержит в себе алюминий, оно не должно реагировать с ним.
https://2ch.hk/ra/res/235952.html#287491 (
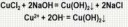 138 Кб, 730x160
138 Кб, 730x160прочитал на англ форуме https://answers.yahoo.com/question/index?qid=20120108025446AAIHKQ0
не понял че делать
вынужден тебя огорчить. Тебе дорога в мед закрыта. Или начинай учить химию через силу , всё получится.
да, удачи. Всё получится
![slide10[1].jpg](/sci/big/thumb/414180/15062452703000s.jpg) 103 Кб, 960x720
103 Кб, 960x720Восстановление железа из ржавчины растворением её в кислотах с электролизом растворимых солей.
Например, Цитрат железа(III) - соль железная соль лимонной кислоты.
Стандартные потенциалы электродных процессов. Железо: https://www.chem-astu.ru/science/reference/potentials/fi.php?a=Fe
Fe(OH)3 + H+ + e- → Fe(OH)2 + H2O; Eo = +0.271
Fe(OH)2 + 2H+ + 2e- → Fe + 2H2O; Eo = -0.047
Fe(OH)2 + 2e- → Fe + 2OH-; Eo = -0.877
Fe(OH)3 + 3H+ + 3e- → Fe + 3H2O; Eo = +0.059
Fe3O4 + 8H+ + 8e- → 3Fe + 4H2O; Eo = -0.085
Fe2O3 + H2O + 2H+ + 2e- → 2Fe(OH)2; Eo = -0.057
Fe3O4 + 8H+ + 2e- → 3Fe2+ + 4H2O; Eo = -0.085
Fe3+ + e- → Fe2+; Eo = +0.771
Fe2+ + 2e- → Fe; Eo = -0.440
Fe3+ + 3e- → Fe; Eo = -0.037
Но, прикол в том, что не всё железо восстанавливается сразу,
и в процессе электролиза растворах солей железа
при наличии ионов железа и гидроксил-ионов,
может снова образовываться ржавчина. Как на пикрелейтед.
Насколько я понял, в таком случае - скорость восстановления железа зависит от плотности тока.
Вот этот пост: http://forum.xumuk.ru/index.php?showtopic=130227&p=655845
Но следующий пост - как-бы намекает на энергоёмкость этого процесса.
Сначала, подумалось мне, для восстановления железа - использовать при электролизе растворимой соли железа
растворитель, не содержащий воды, а значит и гидроксил-ионов,
например какая-нибудь железо-содержащая комплексная соль имизадолия...
Но не найдя такую - я просто пошлю вас за тонкостями куда-то - сюда: http://chem21.info/info/1537388/
![slide10[1].jpg](/sci/big/thumb/414180/15062452703000s.jpg) 103 Кб, 960x720
103 Кб, 960x720Восстановление железа из ржавчины растворением её в кислотах с электролизом растворимых солей.
Например, Цитрат железа(III) - соль железная соль лимонной кислоты.
Стандартные потенциалы электродных процессов. Железо: https://www.chem-astu.ru/science/reference/potentials/fi.php?a=Fe
Fe(OH)3 + H+ + e- → Fe(OH)2 + H2O; Eo = +0.271
Fe(OH)2 + 2H+ + 2e- → Fe + 2H2O; Eo = -0.047
Fe(OH)2 + 2e- → Fe + 2OH-; Eo = -0.877
Fe(OH)3 + 3H+ + 3e- → Fe + 3H2O; Eo = +0.059
Fe3O4 + 8H+ + 8e- → 3Fe + 4H2O; Eo = -0.085
Fe2O3 + H2O + 2H+ + 2e- → 2Fe(OH)2; Eo = -0.057
Fe3O4 + 8H+ + 2e- → 3Fe2+ + 4H2O; Eo = -0.085
Fe3+ + e- → Fe2+; Eo = +0.771
Fe2+ + 2e- → Fe; Eo = -0.440
Fe3+ + 3e- → Fe; Eo = -0.037
Но, прикол в том, что не всё железо восстанавливается сразу,
и в процессе электролиза растворах солей железа
при наличии ионов железа и гидроксил-ионов,
может снова образовываться ржавчина. Как на пикрелейтед.
Насколько я понял, в таком случае - скорость восстановления железа зависит от плотности тока.
Вот этот пост: http://forum.xumuk.ru/index.php?showtopic=130227&p=655845
Но следующий пост - как-бы намекает на энергоёмкость этого процесса.
Сначала, подумалось мне, для восстановления железа - использовать при электролизе растворимой соли железа
растворитель, не содержащий воды, а значит и гидроксил-ионов,
например какая-нибудь железо-содержащая комплексная соль имизадолия...
Но не найдя такую - я просто пошлю вас за тонкостями куда-то - сюда: http://chem21.info/info/1537388/
Тут выше уже советовали Чувурина, почитай его немного, как будет что-то непонятно - открывай Глинку. Как дойдёшь до органики, начинай читать Дядю Фестера. Не то что бы это тебе потом пригодилось, но чтобы химию выучить, ей надо заинтересоваться. Через силу всё это говно выучить нельзя.
Учить тоже нет смысла. Надо понять.
короче детальное изучение рилейтед статей МОЕГО поста выявило следующее (как я это понял):
в конечном итоге автор все таки очистил железо до состояния полной чистоты, порядок
-электролизом в растворе кальцинированной соды получил налет FeO и Fe2O3
-дальше в одном посте он пишет что счищается щеткой Fe2O3, а лимонной кислотой дотравливается FeO с выделением углекислого газа, а в другом наоборот, счищается FeO щеткой после травления, причем во втором случае пишет что выделяется угарный газ при реакции в больших количествах. так или иначе, мы (я) выяснили что после травления он чистит щеткой
- после промывает в воде/не горячем растворе пищевой соды от налета цитрата железа и высушивает/опционально протирает спиртом для высыхания
-ЛИБО смывает несмываемую пленку после травления из кристаллогидратов цитрата железа FeC6H5O7·3H2O и FeC6H5O7·5H2O перекисью водорода (раствором?)
>Кто хочет вспомнить химию
А если я хочу начать химию с нуля? Вообще не помню из школы ничего. Есть какие нибудь вводные книги? Или мне по школьным учебникам пройтись? Тогда какого автора лучше искать?
Если ты взрослый, то тебе не надо школьные вообще читать. Так как при переходе от школьных к нормальным тебе прямым текстом пишут "забудь всё что ты учил в школе, так как это пиздешь".
>Так как при переходе от школьных к нормальным тебе прямым текстом пишут "забудь всё что ты учил в школе, так как это пиздешь".
Погоди, неужели это и в химии так? Я думал, школьные основы норм.
Выходит чёто, что в школе кроме пиздежа ничего не преподают.
В школе преподают не пиздёж, а жёсткое упрощение. В физике, например, полностью выпиливают все признаки матана, заменяя средними алгебраическими соотношениями, лишь в старших классах могу дать намёк на то, что это нужно. В алгебре почти не дают теоремы, сводя всё к технике подсчёта, а в геометрии используют чуть ли не античный подход. И так далее. Ну и абсолютно везде предпочитают вместо строгих и актуальных моделей и определений давать пусть и нестрогое и неактуальное, но зато более интуитивно понятное, наглядное. Сложно объяснить школьнику квантовую-механическую модель атома, которую и более взрослые особи не всегда осиливают, гораздо лучше ему показать модель Резерфорда. Или лучше сказать, что производная - это скорость изменения функции(т.е идёт подмена определения на свойство), ибо "предел отношения приращения функции к приращению аргумента при стремлении приращения аргумента к нулю" заставит объяснить, что такое предел и т.д., да и вообще интуитивно это не впитать.
>Выходит чёто, что в школе кроме пиздежа ничего не преподают.
Охуеть, сука, он понял. ну пиздец, да он же понял. Говоришь-говоришь годами, что школьное обучение не предназначено для того, чтобы давать знания, но нет, блять, опять приходят люди, которые удивляются "ой, как это так, в школе не дают знания?". Школа нужна для того, чтобы ты мог прочитать фамилии кандидатов в бюлетне и поставить галочку там, где тебе скажут в телевизоре.
А чтобы было не сильно палевно, дают какие-то знания в безсистемном упрощеном вид,е отвязаные от какой-либо цели и в темпе, за которым 99% детей не способны успеть.
>>22045
>"предел отношения приращения функции к приращению аргумента при стремлении приращения аргумента к нулю"
Уебанское определение
Я в школьные годы с таким определением столкнулся, и нихуя не понял. Все определения я учил за пару минут до ответа на уроке, и сразу забывал.
Скорость - это и есть исходная сущность, по которой Ньютон писал диференциал. Нынче же в математике популярны абстрактные размышления, что превращает ее из инструмента научного анализа в философию или даже религию, а школьникам потом высирают этого говно на уши вкупе между уроками божьего слова и географией.
мимо призер школьных олимпиад по физике и математике
по поводу химии, это 85% упрощения и 15% пиздежа. Именно так, так как реакция которая в реальности даже близко не хочет идти, это нихуя не упрощение.
 57 Кб, 805x444
57 Кб, 805x444Каких знаете похожих ?
мимо даун
иди отсюда в un
Если по общей, то Третьяков (там первый том по общей химии, второй и третий - о химии элементов),
Некрасов неплох, если совсем основы не знаешь, то можно Глинку взять,
По химии элементов Гринвуд есть, но в нём много лишнего, есть на открытом образовании курс от СПбГУ по химии, там довольно понятно объясняют
Если по органике, то Несмеяновы (но он старый), Касерио, Реутов (но у этих двух более продвинутый уровень), Травень
Но лучше всего взять себе какого-нибудь репетитора, ибо в одиночку это очень геморно изучать
прочитал . все. могу спать идти ?
С чего начать? Какие подводные камни?
И да, гнать на строение атома, это как гнать на арифметику в математике. Зачем тебе химия, если ты азы не знаешь?
>Я думал, после вхк ты можешь быть ученым да и только
фундаметнтальная и ПРИКЛАДНАЯ
и да, никто не посмотрит на твой дипплом. И с науч образованием тебя возьмут технологом скорее всего, наоборот уже тяжко может быть.
>но как то слишком отвлеченно от самой химии, хотя я могу и ошибаться
Это вся химия, когда начнете проходить МО поймешь что я имею ввиду. Можно объяснять все свойства, разные реакции, цвет. Донорные акцепторные свойства, устойчивость. И т.п. Главное понять, как это работает хотя бы на качественном уровне. После этого, соединяются в голове совершеенно разные разделы химии, и ты уже работаешь не с лоскутами а с цельным полотном. Если можно конечно такую аналогию использовать.
 414 Кб, webm,
414 Кб, webm,312x240, 0:10
Не хватило 1 балла на погромиста (поступал с физикой, информатику сдать не было вохможности)
Хватало на 1 мед, но наслушался страшилок, как там ебут в очко с 1 дня+на их уебанском сайте нельзя было нормально мониторить конкурсную ситуацию
Вот так вот
Ну, на вхк уже нельзя перевестись, насколько я знаю
Переведусь на фармфак и буду варить витаминки
Спасибо за совет про МО, начну вникать
А ты думаешь на химфаке не ебут в очко? Еще как ебут, в несколько стволов ебут, особенно на органике.
Моль.. Это как еще один способ посчитать штуки. Как если тебя спросить "сколько было там людей?" Ты можешь ответить "столько то штук".
или" столько то тысяч", или "столько то моль". задачу можно перевести в аналогичную. "Сколько десятков граней с пятью точками, у шести десятков игральных костей?"
> хочу вкатиться в научную работу
делай электролиз, или иди по стопам радиоактивного бойскаута
 191 Кб, 1920x1080
191 Кб, 1920x1080>Есть тут успешноговновары с зп овер 60к?
В бизаче есть точно. Анон, который варит дезинфицирующие растворы, но начинали они пиздец как хуево, собственоручно тягали мешки с едким натром, а потом получили сертификаты, госзакупки, откаты, и началась хорошая жизнь.
Честно, никогда не думал об этом. Как-то либо запомнилось. Либо там названия совпадают названием индивидуальным.
В шкалке нравились эксперименты и задачки хорошо шли. Потом все просто: вуз, нии, аспирантура, степень.
>Погоди, неужели это и в химии так? Я думал, школьные основы норм.
Только если учитель нормальный (маловероятно).
>Выходит чёто, что в школе кроме пиздежа ничего не преподают.
Шкалка должна дать общий кругозор, дать личинке человека понятие о мире и как он в целом устроен. Если он не поймет чем электрон он позитрона отличается, то и хуй с ним, автослесари тоже нужны. А вот если личинке станет что-то интересно, например химия, раз уж тред о химии, то личинка пойдет читать интересные книжки и пытаться куда-то развиваться в этом направлении. Если шкальник нашел свой интерес и начал каким-то образом к нему двигаться, то задача школы может считаться выполненной. Ну а если школотрон ковырялся в носу все 12 классов, а после уроков смотрел всяких долбоёбов на ютубе, то школа со своей миссией не справилась.
А что касается знаний, то да, в школе преподают совершенно оторванную от реальности бессистемную хуйню. В дополнение к уроками химии надо еще минимум столько же уроков по инструментальным методам анализа, и еще столько же по химтеории, как минимум.
>Шкалка должна дать общий кругозор, дать личинке человека понятие о мире и как он в целом устроен
Не должна и не дает - все четко работает. Спроси у любого успешного шкальника, и у знаешь, что он знает о мире. Если школьник нашел свой интерес и начал самостоятельно учиться, то задача школы провалена. Но, к счастью, 98% людей не способны к обучению после школы, так что школа работает нормально.
К слову обо мне, я изучал химию в школе задолго до того, как это "стало мейнстримом". И да, я ковырялся в носу все 15 класов, чуть не проебал диплом, потому что с корешом в дотан катал целыми днями, и чо? Надо еще в школе столько же уроков по фарму аксом в лесу.
Доцент в треде! Я спокоен.
 51 Кб, 483x604
51 Кб, 483x604Двачну, мне в школе попадались такие конченые бездарности среди педагогов что они наоборот отбивали всякое желание заниматься предметом. Это не люди ни разу. При этом моя школа считалась типа илитнай в замкадье, лицей даже не школа. Школа как и армия ставит перед собой задачу отбить мозги и научить послушному монотонному выполнению тупой работы, как и почти все высшее образование кстати. Короче вырастить работника который до старости будет копипастить,
>>22834
Стране как раз нужны слесари, а умные люди не нужны. Слышь работай! По крайней мере в рашке. И если школа, армия и высшее образование отбили желание учиться тогда система тебя не поимела и ты достоин.
Вопрос касается химии-микробиологии.
А именно интересует
1- насколько стабилен йодоформ?
2- сколько по времени он выполняет свое бактерицидное действие?
Интересует применительно стоматологии, т.к. пошла тема, что использование препаратов с йодом как "лекарство в каналы" - так себе ибо очень быстро инактивируется и прекращает выполнять свое антимикробное действие (модники вещают, что буквально сутки и все). Мотивируется это тем , что в канале зуба он вступает в реакцию со всем чем может и на этом фоне идет пройоб всего под этим предлогом вместо йода предлагают ебашить кальций.
Но меня терзают сомнения и топать за стадом модников - нет желания. Поэтому интересуют вопросы касательно длительности антибактериального действия.
Жду помощи от химиков треда.
Угадай. Ответ до безобразия прост
обычный гидрооксид кальция. Щелочную среду создает пиздато до 12 с хуем. Так что просто покупают в магазе мешок кальция и сами бадяжат. И не только кальций. Но и лимонку\хлорку\мта
 689 Кб, webm,
689 Кб, webm,400x300, 0:10
Как будто ебать в очко можно только хуем.
>>22964
вся суть - рваные бесполезные шкальники
Увы это так. Сижу тут один скучаю со школотой. Может ты что-то норм напишешь, и мы сможем обсудить.
Да я сюда с вопросом пришел >>22874
Все эти ионные-ковалентные связи, формулы и прочее нахуй не упало. Пихали этим говном в вузике, но практического применения от этого в моей сфере в 99% случаев нихуя нет. а этот цикл кребся - вообще песня. "если не знаете ответы на билет, то хотя бы его напишите и расскажите". Но нахуя? Нахуя он нужен? Ох уж это чудесное российское образовние.
Ладно, походу надо гуглить учебники по биохимии или что-то подобное, мб там будет инфа по этой теме.
 69 Кб, 150x197
69 Кб, 150x197Заинтересовался после чтения "Начал химии" в девятом классе. К концу учебного года я уже твердо знал, что хочу стать химиком. После отдельных глав "Современной органической химии" Тернея я укрепился в своих намерениях и решил, что буду заниматься органической химией. Ну а после курса теоретических основ неорганической и элементоорганической химии и чтения учебника Хьюи я понял, что буду заниматься элементоорганикой.
>С чего начать?
С поиска подходящей лаборатории на сайте РАН'овских институтов и электронного письма заведующему.
>>22730
>Я думал, после вхк ты можешь быть ученым да и только, что в рашке не очень хорошая перспектива
Кое-кто из моих знакомых перекатывался за рубеж после учёбы.
>>22770
>Переведусь на фармфак
Один мой знакомый как раз пошёл в РАН после этого факультета (да и диплом писал в РАНовском институте).
 1,7 Мб, 456x372
1,7 Мб, 456x372В общем, террористы получили доступ к паре тушек живых, но спящих политиков и учёных и поместили в них микроампулы с ядами.
Какие есть вещества, простые и сверхэффективные в отравительном плане, которые в период от "мгновенной" до "очень быстро" убивают человека, влияя на его: кровь, нервную/мозговую/прочую систему?
Естественно, ампула будет небольшой, малюсенькой, размером с обычную пилюльку, так что вот на такой объём вещества и стоит ориентироваться. Месторасположение ампулы можете выбрать сами, для большей эффективности (я думаю, внутренняя сторона позвоночника самое норм место)
Гугли любые токсины самые опасные.
Сосача гидрохлорид, моментально поражает нс человека превращая его в носителя паразита.
Ботулоксин любого вида, пруф https://ru.wikipedia.org/wiki/Ботулотоксин
около 1 нанограмма на 1 кг веса человека, хватит чтобы убить.
Ты ещё мне дигидроген монооксида предложи, Петросян.
 29,1 Мб, mp4,
29,1 Мб, mp4,1280x720, 0:27
Очевидный цианид очевиден.
1 - стабилен.
2 - сколько надо, столько и выполняет. Биоразложение у него не такое уж и быстрое, а при разложении образуется йод, который через МПО в йодат переходит.
3 - чем твоим умникам сутки действия не нравятся? Дохуя же. Вообще твой вопрос скорее к биохимикам.
>>22892
>обычный гидрооксид кальция
Наркоманы.
>>23033
>Крупная белковая молекула, тупо медленно будет работать
Лол. Нет.
>Лол. Нет.
У тебя пруф отклеился (на то что ботулоксин, пусть даже в СМЖ, будет убивать
от "мгновенной" до "очень быстро"
, а не несколько минут, скажем).
 62 Кб, 1280x1280
62 Кб, 1280x1280Что это? Они не ценные?
 100 Кб, 1200x866
100 Кб, 1200x866>Магнитящиеся металлические цилиндры в серой оболочке. Нашёл в банке с магнитными мешалками в лабе
>Магнитящиеся металлические цилиндры в серой оболочке
>в банке с магнитными мешалками в лабе
>Магнитящиеся цилиндры в оболочке
>в банке с магнитными мешалками
Что бы это могло быть?
Ими наверное магнитные мешалки эти двигают, ну чтоб растворы всякие в пробирках перемешивать этими мешалками.
Или же просто к магнитам добавляют, чтоб как-бы комковались с ними и защищали углы острые, увеличивая площадь.
>1 - стабилен.
я не про его нахождении порошком в банке.
>>23097
>2 - сколько надо, столько и выполняет.
отличный ответ. Прям пять баллов.
> Биоразложение у него не такое уж и быстрое, а при разложении образуется йод, который через МПО в йодат переходит.
До пизды по факту во что и куда переходит. Нужен результат в виде антисептического действия - борьбы с микрофлорой. Такой беглый обзор статей поясняет, что он быстро свой профит проебывает из-за реакции с органикой и не органикой.
>3 - чем твоим умникам сутки действия не нравятся? Дохуя же.
Кальций действует дольше.
>Вообще твой вопрос скорее к биохимикам.
Ок. где их искать? Я так понимаю на борде нет, а этот тред - тред шкальников, сдающих егэ и просто аутирующих
>>23097
>Наркоманы.
чем тебя не устраивает? Совсем не в теме , да?
ты ахуеешь. Еще обычную хлорку разводят до 3% и лимонную кислоту 40% хурярят. И хлоргексидин со спиртом мешают.
>>23007
Чуть не забыл, на сайтах ВХК и РАНовской группы Химфака есть заявки лабораторий (хотя сейчас я их не вижу на сайте ВХК). Попробуй начать с них.
http://funchem.org/?page_id=373
> Химии тред
> ни одной фотографии из кухонной/рабочей лабы
> ни одного репорта о синтезе
> ни одной фотографии о покупке нового стекла
Да я с большим удовольствием посмотрел бы охуевшего латыша.
> Ошибка постинга: Файл слишком большой.
Даже фоточки не запостить.
Я например не хочу фотки с лабы кидать. Подумают "выебывается". У нас мало кому везет с
хорошим обеспечением.
Одним стыдно, другие скромничают. В итоге тред пустой.
 11 Кб, 410x600
11 Кб, 410x600Другое пособие открывать ?
>> ни одной фотографии из кухонной/рабочей лабы
>> ни одного репорта о синтезе
Товарищ майор ну что же вы.
Да пожалуйста
Не гуглится там всякая мед хуйня.
Мы например собакой обозначаем системы типа ядро-оболочка. Например наночастицы Fe@Au железо покрытое золотом. Но мне кажется это и инкапсулированные соединения немного разные вещи.
А чем тебе лимонная кислота не бытовое вещество? В любом магазине, стоит не дорого.
Хуево смывает с ткани фильтра (по сути, многослойной марли) - со временем осадок накапливается. Вспомнил еще про ортофосфорную - или она слабее?
Гроссе, Вайсмантель - Химия для любознательных. Там где-то описывалась качественная реакция на золото в ювелирных изделиях.
Про сам селеноводород не скажу, а вот органические соединения типа R-Se-H пахнут ну пиздец как, тиолы по сравнению с ними просто розами пахнут. Хуй знает, как это описать. Типа тиолов, но сильнее, и у запаха какой-то металлический оттенок. В русской литературе это обычно называют "запах тухлой редьки". Я бы добавил, что это запах концентрированного экстракта тухлой редьки, в котором ты однажды чуть не утонул.
Цианиды, яд рыбы фугу и лягушек-листолазов с ядом скорпиона кстати, что будет, если всеми сразу отравиться?
>До пизды по факту во что и куда переходит. Нужен результат в виде антисептического действия - борьбы с микрофлорой.
Дебич.
> ты ахуеешь. Еще обычную хлорку разводят до 3% и лимонную кислоту 40% хурярят. И хлоргексидин со спиртом мешают.
Это ты в сарказм пытался?
>>23453
Нахуй пройдите, товарищ майор.
>>23633
Насрать на силу кислоты. Тебе нужна высокая растворимость образующихся солей. Ну и смотри по википедии, какие соли кальция лучше растворяются. Короче бери уксус и не выёбывайся.
>Сам я биолог с уклоном понятное дело в нейрофизиологию.
Хорошо, значит, на Ленинджера тебя посылать не надо.
Можешь пролистать Ашмарина, "Нейрохимия", просто для того, чтобы проверить свои знания. Ещё есть Альберт, "Избирательная токсичность", тоже заебатый учебник. Потом кури маны по биндингу, Autodock тот же самый, чтобы понимать, как рассчитывается связывание вещества с протеином.
Впрочем, если тебя новые и перспективные вещества не интересуют и ты просто хочешь варить говно - тогда всё вышеперечисленное тебе не нужно, а нужно тебе загуглить архив Erowid. Более подробных мануалов я ни в интернетах, ни в книгах не видел, равно как и лучшего собрания синтезов. Если что-то будет непонятно или сомнительно - открываешь либо Губена, либо Бартона и проверяешь.
Ну и вот тебе книжка, которая даст нормальную теоретическую подготовку - Grossman, The Art of Writing Reasonable Organic Reaction Mechanisms
Тинкаль и Финкаль сашеньки. Если попроще то ищи остатки мпаба, еровинда и ентеогена. Если совсем попроще то записи бабы нюры но я не рекомендую пробовать повторять ту хуйню которая там написана. Твой интерес похвален но имхо нездоров. Вкатись лучше в че попроще типа нейрометаболиков.
>>23694
Сначала закончи первый курс. Мне кажется ты сам не знаешь чего хочешь и не понимаешь о чем говоришь особенно позабавило
>как устроена современная химия
Научись правильно формулировать вопросы для начала.. Горячие направления там где большое бабло, это фарма и это нефть. В России сосание хуев. Декану ты нахуй не вперся со своими тупыми вопросами.
> это фарма и это нефть.
Ну это и так ясно и так уже давно, хочется больше конкретики - какие именно направления в них, какие технологии и какие вещества.
> Научись правильно формулировать вопросы для начала..
Что не так с этой формулировкой?
>какие технологии и какие вещества
Это NDA. Надеюсь ты в курсе что это такое.
>Что не так с этой формулировкой?
То что она не корректна и не конкретна. Если ты не можешь набрать в гугле "характеристика отрасли" то ты хуй. Чем раньше ты отучишься задавать тупые вопросы и научишься искать инфу сам тем раньше ты станешь человек.
> Это NDA. Надеюсь ты в курсе что это такое.
Нашёл только такое. https://en.wikipedia.org/wiki/Nondestructive_testing
> То что она не корректна и не конкретна.
Я дальше в посте развернул её.
> Если ты не можешь набрать в гугле "характеристика отрасли" то ты хуй.
Забил в Яндекс - выдало набор рефератоподобной херни про химическую промышленность.
NDA (Non-disclosure agreement).
Ты ротешник свой развернул. Говори по делу, коротко и ебко, всем похуй че ты там развернул если начал с хуйн.
Хуяндексе, ты меня заебал, тупой малолетний еблан. Иди на сварщика.
Малолетний даун, иди играй в доту.
1)Методом электр. баланса поставте коэф. в уравнение. Mg-+HNO3->Mg(NO3)2+NH4NO3+H2O
2)При действие паров H2O на Fe образовалось 200 л H. Опред.m вступившего Fe в реакцию.
3)Определите m 10% Na(OH) который необходим для полной нейтрал. 245 гр. 10% H2SO(хз 4 или 3)
П.с. помогите решить. желательно с объяснениями. Половину знаю как делать, а потом застреваю.
2)
Шалом, двач. Я с вопросом.
Чем определяются стандартные энтальпии образования и энергия химической связи?
Ответившему ящик каквсегданихуя.
> Вкатись лучше в че попроще типа нейрометаболиков.
Так фенилэтилпмины же не сложные, разве нет?
Лол.
Раньше пользовался раствором для гидропоники который теперь не продается, я решил его сделать сам, состав изначального раствора такой:
P₂O₅ - 5%
K₂O - 4%
Mg - 1.5%
S - 1%
У меня есть вроде бы все компоненты чтобы самому сделать такой раствор, а точнее 20% раствор KOH, концентрированная H₃PO₄ и MgSO₄ в порошке.
Для начала я решил сделать всего 50 мл раствора, для чего я все посчитал наверняка криво и развел в небольшом количестве воды 6.5 грамм сульфата магния, после чего влил туда 10 мл KOH после чего сразу выпал осадок белого цвета, как я понимаю я получил K₂SO₄ и Mg(OH)2 который нерастворим в воде.
Как лучше смешать эти три компонента чтобы получить то что мне нужно не получая ничего в осадок?
Переводить реактивы за зря не хочу.
Сразу возникла мысль повторить то же самое но уже не в 50 мл, а в 500 мл. воды и просто добавлять в раствор в 10 раз больше, но может быть есть более умный вариант?
Извините если платина.
>K₂O
>влил KOH
- а чего не оксид калия то?
>концентрированная H₃PO₄
Не, не, не - так не правильно, ели написано
>P₂O₅
- то добавляй именно в вид фосфорного ангидрида!
Извини не удержался, но это реально пиздец и "торжество ЕГЭ".
При этом человек имеет доступ к реактивам, т.е. видимо имеет какое-то отношение к химии и пользоваться Гуглом, хотя бы на уровне - "скачать реферат ..." - должен уметь.
>Чем определяются стандартные энтальпии образования и энергия химической связи?
Википедию прочитать лень, да, проще в полудохлый тред написать? Стандартная энтальпия образования - это количество теплоты, выделяемое (или затрачиваемое) при образовании моля вещества из простых веществ. Разумеется, никто не будет, допустим, синтезировать парацетамол из углерода, азота, водорода и кислорода и замерять поглощённую теплоту, это нереально. И тут приходит на помощь такое обобщение, как энергия химической связи. Грубо говоря, для некоторых веществ энтальпия образования получена экспериментально, на основании этих экспериментальных данных были построены модели, которые позволяют рассчитывать энергию связи. А когда мы знаем энергию связи, мы можем предсказывать теоретически стандартную энтальпию образования для веществ, у которых мы даже не знаем пути синтеза.
>>23723
В первом - сказано же, что метод электронного баланса. Расставляй степени окисления над магнием и над азотом, дальше будет понятно, что делать.
Во втором - запиши реакцию. У железа там будет степень окисления 3 справа. Переведи литры в моли, посмотри соотношение по железу, получи, сколько тебе нужно молей железа, умножь моли на молярную массу железа. Всё.
В третьем - H2SO4, инфа соточка. Всё так же - запиши реакцию, переведи в моли, потом из молей получаешь массу NaOH и умножаешь на 10.
>>23740
>фенилэтилпмины
Ты уже по клавишам не попадаешь, торчок ёбаный.
>>23775
Нахуя ты KOH влил, наркоман штоле? Ах да, с гидропоникой, значит, наркоман. Во-первых, что тебе мешает тупо нагуглить точный состав твоей смеси? Я тебе гарантирую, что ни одного компонента из тобою указанных там нет - ни оксида калия, ни металлического магния, ничего другого. Это просто был пересчёт на "чистые элементы", для удобства. Во-вторых, когда пишут что-то про "эквивалент оксида калия", это, скорее всего, нитрат калия, обычная селитра. Её и кидай вместо KOH, азот можешь даже не считать по процентам, его много не бывает.
Кстати, сульфат магния у тебя скольки-водный, ты это считал? А то проебёшься с серой и магнием, и вырастет у тебя не гордый куст, а сопля размером с твой хуй.
>Чем определяются стандартные энтальпии образования и энергия химической связи?
Википедию прочитать лень, да, проще в полудохлый тред написать? Стандартная энтальпия образования - это количество теплоты, выделяемое (или затрачиваемое) при образовании моля вещества из простых веществ. Разумеется, никто не будет, допустим, синтезировать парацетамол из углерода, азота, водорода и кислорода и замерять поглощённую теплоту, это нереально. И тут приходит на помощь такое обобщение, как энергия химической связи. Грубо говоря, для некоторых веществ энтальпия образования получена экспериментально, на основании этих экспериментальных данных были построены модели, которые позволяют рассчитывать энергию связи. А когда мы знаем энергию связи, мы можем предсказывать теоретически стандартную энтальпию образования для веществ, у которых мы даже не знаем пути синтеза.
>>23723
В первом - сказано же, что метод электронного баланса. Расставляй степени окисления над магнием и над азотом, дальше будет понятно, что делать.
Во втором - запиши реакцию. У железа там будет степень окисления 3 справа. Переведи литры в моли, посмотри соотношение по железу, получи, сколько тебе нужно молей железа, умножь моли на молярную массу железа. Всё.
В третьем - H2SO4, инфа соточка. Всё так же - запиши реакцию, переведи в моли, потом из молей получаешь массу NaOH и умножаешь на 10.
>>23740
>фенилэтилпмины
Ты уже по клавишам не попадаешь, торчок ёбаный.
>>23775
Нахуя ты KOH влил, наркоман штоле? Ах да, с гидропоникой, значит, наркоман. Во-первых, что тебе мешает тупо нагуглить точный состав твоей смеси? Я тебе гарантирую, что ни одного компонента из тобою указанных там нет - ни оксида калия, ни металлического магния, ничего другого. Это просто был пересчёт на "чистые элементы", для удобства. Во-вторых, когда пишут что-то про "эквивалент оксида калия", это, скорее всего, нитрат калия, обычная селитра. Её и кидай вместо KOH, азот можешь даже не считать по процентам, его много не бывает.
Кстати, сульфат магния у тебя скольки-водный, ты это считал? А то проебёшься с серой и магнием, и вырастет у тебя не гордый куст, а сопля размером с твой хуй.
 48 Кб, 421x67
48 Кб, 421x67>- а чего не оксид калия то?
Из чего было из того и мешал.
>это реально пиздец и "торжество ЕГЭ".
Когда я закончил школу ЕГЭ еще не было.
А к реактивам доступ может получить кто угодно сходив в магазин с удобрениями или даже заказав с доставкой от 25 кг нужного реактива просто позвонив по телефону в мелкооптовую химическую контору. Это у меня просто хобби.
>>23780
>Я тебе гарантирую, что ни одного компонента из тобою указанных там нет - ни оксида калия, ни металлического магния, ничего другого.
Похоже ты прав, но только частично. Пик релейтед.
>когда пишут что-то про "эквивалент оксида калия", это, скорее всего, нитрат калия, обычная селитра. Её и кидай вместо KOH, азот можешь даже не считать по процентам, его много не бывает.
А вот тут ты не прав, у меня стоит мешок калийной силитры и там N и K по 15% поровну, а нужен бы мне был азот, я бы не мешал фосфорно-калийное удобрение.
>Кстати, сульфат магния у тебя скольки-водный, ты это считал
7-водный, как я понимаю не водный сульфат магния на воздухе вообще не хранится, и конечно это считал.
В любом случае, что можно сделать с теми компонентами что у меня есть? Как я понимаю совершенно похуй в виде какой соли калий, фосфор и магний с серой, главное чтобы они растворялись в воде.
Вот есть у меня KOH 20% фосфорная кислота на которой написано 59% P₂O₅ и сульфат магния. Больше нихуя, я бы мешал каждый раз всего в нужных пропорциях, но просто хочу облегчить себе жизнь и вместо того чтобы брать три разных концентрата из трех рахных емкостей набирать из одной. Неужели это нерешаемо?
Пересчитай все компоненты на свои вещества. Например если пишут K2O, то пересчитывай на калий. И смешивай всё в порядке таком,
берешь воду, добавляешь кислоты (не бери сразу всю воду). Растворяешь соли все, если не растворяются полностью немного добавь воды, потом медленно добавляй KOH и перемешивай, осадок не должен выпадать. если будет, то тут же растворится. Так ты двигаешься из кислого pH и даже не попадаешь в щелочной, где у тебя выпадают разные осадки.
 9 Кб, 650x95
9 Кб, 650x95>берешь воду, добавляешь кислоты (не бери сразу всю воду). Растворяешь соли все, если не растворяются полностью немного добавь воды
Спасибо за совет.
Однако, я забил это в wolframalpha и там выдало пикрелейтед, значит в процессе смешивания сульфата магния и фосфорной кислоты получится фосфат магния который тоже не растворим в воде?
Или он по какой-то причине не успеет образоваться?
http://www.wolframalpha.com/input/?i=phosphoric+acid+++magnesium+sulfate+->+magnesium+phosphate+++H2O4S&lk=1&rawformassumption="ClashPrefs"+->+"ClashPrefs"
 32 Кб, 490x338
32 Кб, 490x338Не смотри на вольфрам альфу. Если ты двигаешься из кислого ПШ, то на пути к гидрофосфату будет стоять дигидрофосфат. а он не дает осадка.
ниухя не понял че ха ъкня ЭЭ БЛЕ
 926 Кб, 1280x704
926 Кб, 1280x704В общем, нам всегда говорили что при формировании химической связи энергия затрачивается, а когда связь разрывается энергия выделяется
Но у меня тут курс биохимии и препод настаивает на том, что все ровным счетом наоборот. Но он сразу внятно не объяснил, а подходить и переспрашивать мне как то стремно.
Где истина? Я так понимаю все зависит от точки зрения. Поясните в чем смысл и что это могут быть за точки.
 38 Кб, 521x600
38 Кб, 521x600Тоже этот вопрос волновал, но препод так внятно ничего не объяснил.
Насколько я понял, энергия всё таки выделяется при образовании связи. Суть в том, что в биологических реакциях при разрыве какой-то связи (в процессе того же окислительноого фосфорилирования) образуются никомолекулярные соединения (в пределе - углекислый газ и вода). И суть в том, что итоговое количество этих связей оказывается больше, чем было в начале реакции (ну или точнее количество энтропии повысилосьХотя вопрос с энетропией мне тоже не до конца ясен. Когда я спрашивал, что подразумевается под ней с точки зреня более строгого формального определения, то мне говорили, что энтропия повышается, если увеличивается количество возможных движений у молекулы, скажем, если она становится длиннее, значит она может совершать больше колебаний и принимать больше разных форм, поэтому по идее её энтропия должна стать больше. Но с другой стороны я слышал точку зрения, что энтропия повышается в случае образования низкомолекулярных соединений, что в общем-то противоречит предыдущей концепции, поскольку количество возможных движений этих молекул уже значительно меньше, только всякие колебания и пр. Хз что правильно), поэтому образование этих связей в низкомолекулярных соединениях приводит к образованию энергии, потому что соединения более стабильны, устойчивы, чем то, что было до них.
А вот если сузить горизонт рассмотрения до отдельной связи (а не химической связи в целом), то при разрыве связи, конечно же, энергия затрачивается. То в биологических реакциях часто элементы, образованные из разорванной связи, затрачиваются на образование новых связей, которые энергию выделяют.
А вообще преподы пидоры. Они должны были превосходно понимать, какие вопросы возникнут у студентов (просто потому, что они эту хуйню уже много лет преподают), и объяснять их превентивно.
Возможно, когда химики говорят, что на образование связи затрачивается энергия, они просто подразумевают, что энергия не может идти самопроизвольно.
Хуй знает. Курс биохимии уже прошёл и нет возможности спросить, да и препод был не очень дружелюбно настроен.
 38 Кб, 521x600
38 Кб, 521x600Тоже этот вопрос волновал, но препод так внятно ничего не объяснил.
Насколько я понял, энергия всё таки выделяется при образовании связи. Суть в том, что в биологических реакциях при разрыве какой-то связи (в процессе того же окислительноого фосфорилирования) образуются никомолекулярные соединения (в пределе - углекислый газ и вода). И суть в том, что итоговое количество этих связей оказывается больше, чем было в начале реакции (ну или точнее количество энтропии повысилосьХотя вопрос с энетропией мне тоже не до конца ясен. Когда я спрашивал, что подразумевается под ней с точки зреня более строгого формального определения, то мне говорили, что энтропия повышается, если увеличивается количество возможных движений у молекулы, скажем, если она становится длиннее, значит она может совершать больше колебаний и принимать больше разных форм, поэтому по идее её энтропия должна стать больше. Но с другой стороны я слышал точку зрения, что энтропия повышается в случае образования низкомолекулярных соединений, что в общем-то противоречит предыдущей концепции, поскольку количество возможных движений этих молекул уже значительно меньше, только всякие колебания и пр. Хз что правильно), поэтому образование этих связей в низкомолекулярных соединениях приводит к образованию энергии, потому что соединения более стабильны, устойчивы, чем то, что было до них.
А вот если сузить горизонт рассмотрения до отдельной связи (а не химической связи в целом), то при разрыве связи, конечно же, энергия затрачивается. То в биологических реакциях часто элементы, образованные из разорванной связи, затрачиваются на образование новых связей, которые энергию выделяют.
А вообще преподы пидоры. Они должны были превосходно понимать, какие вопросы возникнут у студентов (просто потому, что они эту хуйню уже много лет преподают), и объяснять их превентивно.
Возможно, когда химики говорят, что на образование связи затрачивается энергия, они просто подразумевают, что энергия не может идти самопроизвольно.
Хуй знает. Курс биохимии уже прошёл и нет возможности спросить, да и препод был не очень дружелюбно настроен.
>>23884
Так ребят. вы какие-то потерянные. Сейчас поясню. Короче, все хим связи почти,
бывают исключения, но долго не живут образуют A+B=AB всегда понижают энергию общей системы атомов AB. как вы понимаете, это значит что для сохранения она должна куда-то уйти, уходит в тепло или излучается. Вопрос в том, откуда тогда берутся реакции с затратой энергии? Дело в том, что надо учесть что некоторые связи рвутся, а некоторые образуются и тут уже надо понимать кто победит. Например разложение воды 2H2O=2H2+O2 рвется 4 связи OH образуется две связи H-H и одна O=O ; Если всё пересчитаете, то выйдет что это невыгодно. Наборот, оксид азота 2NO=N2+O2, тут сумма энергий от связей кислорода и азота больше, чем две связи NO, поэтому энергия выделяется. Как-то так.
Так, теперь по поводу энтропии. Вообще если строгим быть. то надо поднимать кванты и пояснять что у каждой системы своя система уровней. Но проще конечно через классическую механику. Представь себе что частицы газа двигаются, туда сюда. Так вот ты пытаешься изобразить все импульсы и координаты каждой молекулы газа, и для каждой вносишь новую ось. Поэтому если у тебя одна молекула, то у тебя уже шестимерное пространство, но для одной молекулы скучно, а вот для N тебе придется вводить 6N осей, три для импульса, и 3 для координат. получается одна точка в этом пространстве задает сразу все положения и скорости всех частиц в стакане. Ну так как импульсы и скорости меняются, то конечно эта точка будет как-то плавать в этом пространстве. Учитывая что энергия всех молекул сохраняется, то для этой точки УЖЕ есть ограничение для её движений, поэтому она уже будет двигаться только по какой-то плоскости в своём 6N мерном пространстве. так вот, мы считаем, что она будет "плавать" по всей ней постоянно, в разных местах, и очееень быстро. Так вот энтропия, это мера этой вот площади этой поверхности. Это какая свобода для импульсов энергий и положений есть у молекул данного тела. Понятно что для газа будет намного больше значение. Или для маленькой молекулы. Если в растворе из одной частицы получается две, то энтропия скорее всего вырастет. А например у кристалла, не так много значений координат и ипульсов, ибо ионы колеблятся вокруг своих мест в решетке. поэтому энтропия маленькая.
химик-кун
>В общем, нам всегда говорили что при формировании химической связи энергия затрачивается, а когда связь разрывается энергия выделяется
Ты все перепутал. Если бы так было, то атомы просто болтались бы в пространстве, не взаимодействуя между собой.
>>23884
>Но с другой стороны я слышал точку зрения, что энтропия повышается в случае образования низкомолекулярных соединений, что в общем-то противоречит предыдущей концепции, поскольку количество возможных движений этих молекул уже значительно меньше, только всякие колебания и пр. Хз что правильно
Ты забыл про поступательное движение: фрагменты могут лететь куда угодно, а не болтаться друг рядом с другом. При прочих равных энтропия определяет направление равновесных процессов (пример - образование хелатных комплексов, когда полидентатный лиганд вытесняет аналогичные монодентатные). Про вклад энтропии в других случаях я, к сожалению, ничего не могу сказать.
Я и так единственный кто вопросы задает на паре, чувствую себя дауном.
>>23884
>>23923
Как я понял из ваших объяснений, энергия затрачивается только с точки зрения некоторого внешнего воздействия, например нагревания, если оно необходимо. Но если мы говорим только системе атомов участвующих в реакции, то энергия выделяется?
Если тут есть те кто шарят в биохимии, можно тоже самое, но на примере фосфорилирования АДФ и гидролиза АТФ, пожалуйста.
Википедия кстати пишет что при разрыве связи, энергия таки выделяется.
>Гидролиз макроэргических связей молекулы АТФ, >сопровождаемый отщеплением 1 или 2 остатков фосфорной >кислоты, приводит к выделению, по различным данным, от 40 до >60 кДж/моль.
Гидролиз АТФ будет тебе образовывать две связи OH и рвать две связи O-P; Их собственно разность и даст 40 кДж.
Спасибо, анон. Действительно получилось.
Попутно спрошу еще один вопрос, пытался гуглить нихуя не понял. У меня есть дохуя калийной селитры KNO₃ но мне нахрен не нужен из нее азот, мне нужен только калий. Как-то можно в домашних условиях убрать оттуда азот и получить только калий при условии что познания в химии у меня ниже среднего?
Для гидропоники-то азот не нужен? Ну-ну.
Впрочем, если ты так настаиваешь на этом, можешь купить поташ, он же карбонат кальция. Переводить куда-то калийную селитру смысла нет, дешевле купить.
>Для гидропоники-то азот не нужен? Ну-ну.
Это не совсем релейтед к сабжу. Но как я понима ты хочешь чтобы я тебе объяснил в подробностях. Сказать что азот не нужен будет неправильно, сказать что он нужен всегда это тоже не совсем правильно. Дело в том, что как правило азота и так дохуя во всех комплексных удобрениях, достаточно часто его уже дохуя вместе с одними только микроэлементами потому конкретно у меня складывается ситуация что мне для азота достаточно одной бутылки комплексных микроэлементов.
Если же речь про стадию цветения и плодоношения, то избыточный азот вообще становится вредным, так как препятствует цветению и плодоношению. Да, он необходим, но много азота не заебись, для полноценного цветения его надо прям совсем чуть чуть. В конце концов даже если выращиваешь палки и листья, то азот тоже полезен до определенного предела, переизбыток азота как правило блокирует магний и растению это нихуя не заебись. В то время как передознуть к примеру калием в разы сложнее, его нужно по сравнению с азотом налить в 4-6 раз больше. И в то время как дефицит азота на цветении и на плодоношении процесс вполне естественный даже на земле, то к примеру дефицит того же калия в разы опаснее и без последствий проходит очень редко, а на стадии плодоношения так вообще грозит существенной потерей урожая. про переизбыток нитратов в плодах вообще умолчу я думаю и так понятно
Потому удобрения содержащие калий и фосфор выходят куда ценнее чем вагон азота в той же селитре. Я вообще с трудом понимаю для кого эта селитра производится в таких количествах.
>карбонат кальция
Но это все же нужно будет перевести в KOH?
Для стерильной среды твои рассуждения верны. Для нестерильной среды или для выращивания в грунте - нет, потому что там живут бактерии, которые очень любят жрать азот в виде нитрата и переводить его в неусваиваемый растениями азот в виде N2. Собственно, для грунта такие бешеные количества связанного азота и нужны.
>Но это все же нужно будет перевести в KOH?
Вот ты решил взять слабощелочное соединение и перевести его в едкий кали. Вопрос "как" оставим, лучше скажи, зачем? Ты боишься закисления от углекислоты? Можешь не бояться, углекислота прекрасно усваивается растениями, даже лучше, чем CO2 из воздуха.
>Для стерильной среды твои рассуждения верны
Что из себя и представляет классическая гидропоника, где кормится не микрофлора, а непосредственно растения.
>Вот ты решил взять слабощелочное соединение и перевести его в едкий кали. Вопрос "как" оставим, лучше скажи, зачем? Ты боишься закисления от углекислоты? Можешь не бояться, углекислота прекрасно усваивается растениями, даже лучше, чем CO2 из воздуха.
Собственно, почему я не хочу иметь углерод в растворе есть две причины:
Углерод в зоне корней будет кормом для всякой микрофлоры, как полезной так и не очень. Возвращаясь к предыдущему вопросу, в земле углерод не страшен и даже чем-то полезен, в гидропонике ему точно не место. Многие ставят как раз разницу между минеральными удобрениями и органическими как раз по наличию углерода, где есть углерод то уже можно считать органикой.
Хотя, я вот погуглил нашел для начала вот это видео https://www.youtube.com/watch?v=WRLYH7Svmgs затем погуглил еще и нашел такую реакцию
K2CO3 + 2H3PO4 → 2KH2PO4 + H2O + CO2 получается фосфорная кислота прореагирует с карбонатом калия и будет то что мне нужно?
Хотя, подожди, у меня же обычная селитра KNO₃ с ней можно извлечь хоть какой-то профит?
Если ты пытаешься неумело троллить, то нарвешься тупо на пожелание тебе завалить всё что можно завалить. В этот момент, ты можешь спросить совета знающего анона, а можешь пройти нахуй.
Ты прямо полную стерильность обеспечил? Уважуха, сложное занятие. Хотя не столько сложное, сколько муторное.
>Углерод в зоне корней будет кормом для всякой микрофлоры, как полезной так и не очень.
Ты же рассчитывать его по калию будешь, там углерода будет в количестве как для микроэлемента. Ну допустим, вырастут у тебя какие-то бактерии (на самом деле нет, весь углерод сожрут растения). Ну и сколько их там вырастет без нормального источника углерода и без света? Не думаю, что это критично.
>K2CO3 + 2H3PO4 → 2KH2PO4 + H2O + CO2 получается фосфорная кислота прореагирует с карбонатом калия и будет то что мне нужно?
Чем поташ переводить, купи обычный монофосфат калия на сельхозрынке.
>Хотя, подожди, у меня же обычная селитра KNO₃ с ней можно извлечь хоть какой-то профит?
Теоретически можно, обменной реакцией с каким-то другим фосфатом. Но проблема потом получается в разделении продуктов реакции. Обе соли растворимы, так что разделять их только на основе разницы в растворимости, и получишь ты (после долгой еботни с холодильником) достаточно грязный продукт. Почему проходит фокус с поташом, который не проходит с селитрой? Потому что один из продуктов реакции в итоге разлагается с выделением газа. Короче говоря, опять же повторю, лучше купи фосфат калия и пересчитай всё на него. Тем более что в оригинальном составе фосфора было много.
>>24318
Ну так перекатывай.
Сам перекатывай.
Вы видите копию треда, сохраненную 8 февраля 2018 года.
Можете попробовать обновить страницу, чтобы увидеть актуальную версию.
Скачать тред: только с превью, с превью и прикрепленными файлами.
Второй вариант может долго скачиваться. Файлы будут только в живых или недавно утонувших тредах. Подробнее
Если вам полезен архив М.Двача, пожертвуйте на оплату сервера.
![0fa6b4fddf2e3facdf00a9775b3d3ed1[1].jpg](/sci/big/thumb/414180/14965435412070s.jpg)
![D0A2D0B0D0B1D0BBD0B8D186D0B0-D09CD0B5D0BDD0B4D0B5D0BBD0B5D0[...].jpg](/sci/big/thumb/414180/14965435412101s.jpg)
![S10-03-cikl-trikarbonovyh-kislot[1].jpg](/sci/big/thumb/414180/14965435412112s.jpg)


![2f9d4c83ec6166b1d190076e30bcd626b0d89726r9605215[1].png](/sci/big/thumb/414180/14966331903720s.jpg)
![14240336102663[1].jpg](/sci/big/thumb/414180/14966331903791s.jpg)




![C60a[1].png](/sci/big/thumb/414180/14972763777230s.jpg)
![Buckminsterfullereneanimated[1].gif](/sci/big/thumb/414180/14972763777241s.jpg)

![222-1-14-1[1].png](/sci/big/thumb/414180/14973058395380s.jpg)
![220px-SpinOne-Half28Slow29[1].gif](/sci/big/thumb/414180/14973058395381s.jpg)
![Magneticpoles-1[1].jpg](/sci/big/thumb/414180/14973058395442s.jpg)

![Polosovoj-magnit1[1].jpg](/sci/big/thumb/414180/14973142290721s.jpg)
![220px-Halbach2.svg[1].png](/sci/big/thumb/414180/14973146302190s.jpg)
![halbacharraymagneticfield[1].png](/sci/big/thumb/414180/14973146302191s.jpg)
![440px-FridgeMagnetHalbach.svg[1].png](/sci/big/thumb/414180/14973146302192s.jpg)




![tumblrnpo6fyKqK11t3xfbso11280[1].jpg](/sci/big/thumb/414180/14979476728081s.jpg)
![legtattooshka[1].jpg](/sci/big/thumb/414180/14979476728092s.jpg)
![scientifictattoos26[1].jpg](/sci/big/thumb/414180/14979476728093s.jpg)
![1himicheskaya-strukturnaya-formula-holesterina-svoystva-str[...].gif](/sci/big/thumb/414180/14980123808160s.jpg)
![steroids[1].png](/sci/big/thumb/414180/14980123808161s.jpg)


![image105[1].gif](/sci/big/thumb/414180/14992394780220s.jpg)
![image107[1].gif](/sci/big/thumb/414180/14992394780221s.jpg)
![image109[1].gif](/sci/big/thumb/414180/14992394780222s.jpg)
![slide-12[1].jpg](/sci/big/thumb/414180/14992530892190s.jpg)
![image089[1].jpg](/sci/big/thumb/414180/14992530892191s.jpg)
![400px-Streckeraminoacidsynthesisscheme.svg[1].png](/sci/big/thumb/414180/14992530892192s.jpg)
![image060[1].gif](/sci/big/thumb/414180/14992530892193s.jpg)






![1501184071171452321[1].jpg](/sci/big/thumb/414180/15077275492580s.jpg)